
CC: Gonzalo Jara / Associació Cetàcea
Es pot confondre amb: Cap d’olla gris
Taques de pigmentació de l’aleta dorsal.
Patró de natació:
Estat de conservació al Mediterrani: Vulnerable (UICN)
![]()
Estat de conservació al món: Preocupación menor (UICN)
![]()
El dofí mular (Tursiops truncatus) és un cetaci que pertany a la família delphinidae dintre de l’ordre dels odontocets. És segurament un dels cetacis més coneguts ja que és dels més comuns en els delfinaris d’arreu del món i al cinema o la televisió. Es tracta d’un dofí gran, bastant robust amb un musell més aviat curt i gruixut, separat clarament del meló. L’aleta dorsal, que és alta, de base ampla, falcada i amb la punta punxeguda està situada en una posició bastant centrada. Les aletes pectorals són moderadament llargues, fines, fosques i amb les puntes una mica punxegudes.
Presenta una coloració bastant monocromàtica i poc diferenciada, essent les parts dorsals i laterals més aviat fosques (tot i que pot variar des de gris clar fins a quasi negre) i la part ventral blanca, a vegades amb tonalitats rosàcies. Alguns exemplars poden presentar una marca més clara i allargada des de sobre les aletes pectorals fins a la zona de la capa, anterior a l’aleta dorsal.
Presenta entre 36 i 54 dents punxegudes a ambdues mandíbules. Els animals adults les poden estar més aviat gastades o fins i tot absents.
És una de les espècies de la família delphinidae que presenta els exemplars més grans. La seva mida màxima varia en funció de la regió i, aparentment, ho fa de forma inversament proporcional a la temperatura. En general poden arribar a mesurar entre 1,9 i 4,1 metres, essent els mascles lleugerament més grans que les femelles. Els individus més grans es troben a l’Atlàntic nord-est, al voltant del Regne Unit. La seva mida al néixer oscil·la entre els 85 centímetres i els 1,4 metres. El pes màxim pot arribar als 650 kgs, tot i que en general pesen bastant menys.
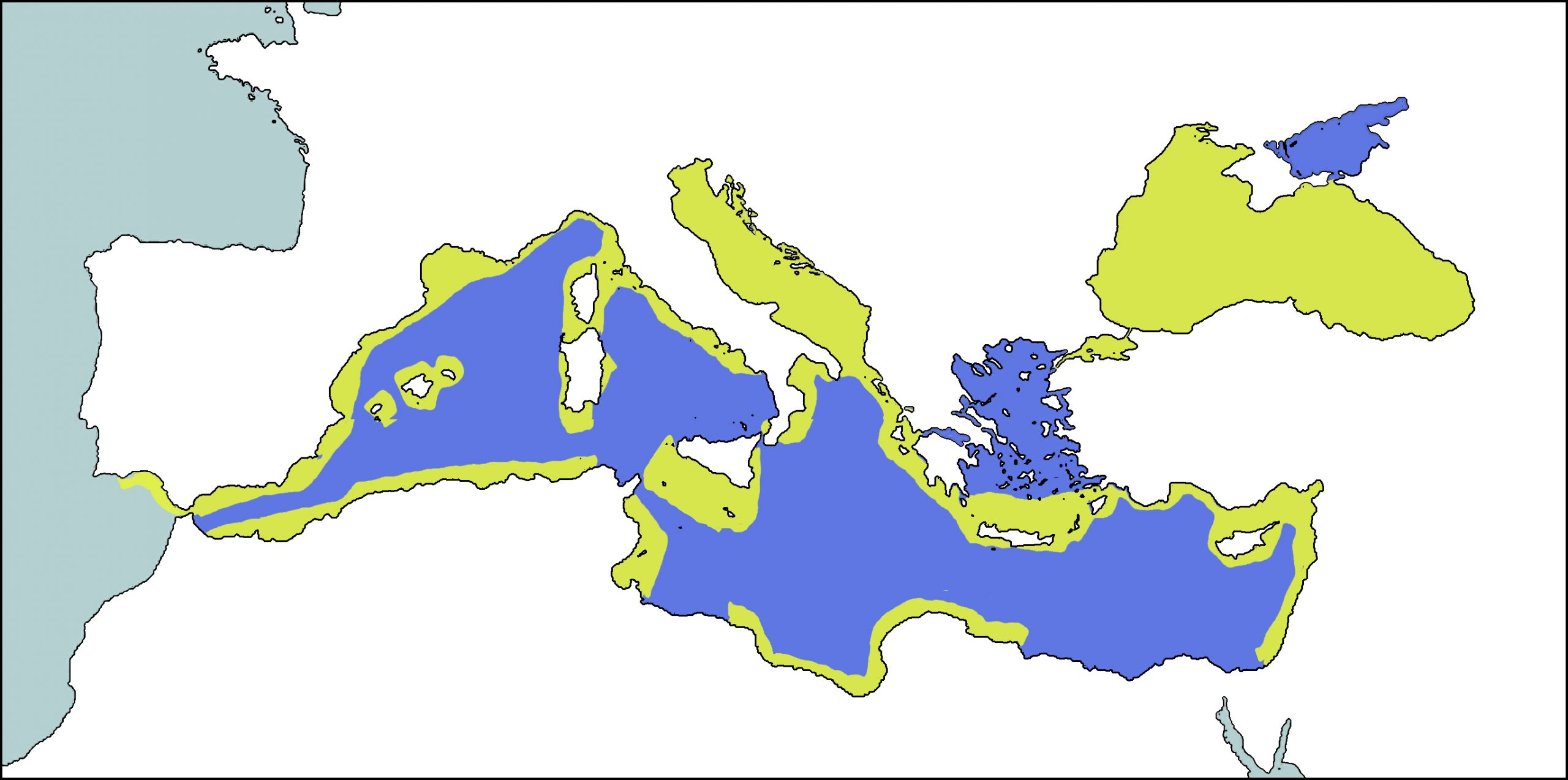
El dofí mular és una espècie distribuïda àmpliament per tot el planeta, però en especial en aigües costaneres i a la plataforma continental de les regions tropicals i temperades. Al Mediterrani, es creu que era una espècie que es distribuïa de forma continua per les aigües costaneres. A la actualitat, segueix sent més abundant a les aigües properes a les costa, sobretot en aquelles situades sobre la plataforma continental, i més rarament en zones més pelàgiques, tot i que la seva distribució està més fragmentada (Reeves & Notarbartolo di Sciara, 2006). Ha sigut albirat per tota la conca mediterrània, des de l’estret de Gibraltar fins al de Dardanels, sobretot a la part nord, on ha estat més estudiat, tot i que també se l’ha vist a la costa de Tunísia i altres zones de la costa nord d’Àfrica. També es freqüent en arxipèlags com el de les Balears i illes com ara Còrsega, Sardenya i Sicília (Forcada et al, 2004; Bearzi, et al, 2008a). És abundant al mar Negre, al mar Adriàtic, en certes zones de la mar Egea, a les costes nord i oest de Còrsega i Sardenya, a la costa argeliana hi ha certes àrees de les costes catalanes i del sud de la península ibèrica.
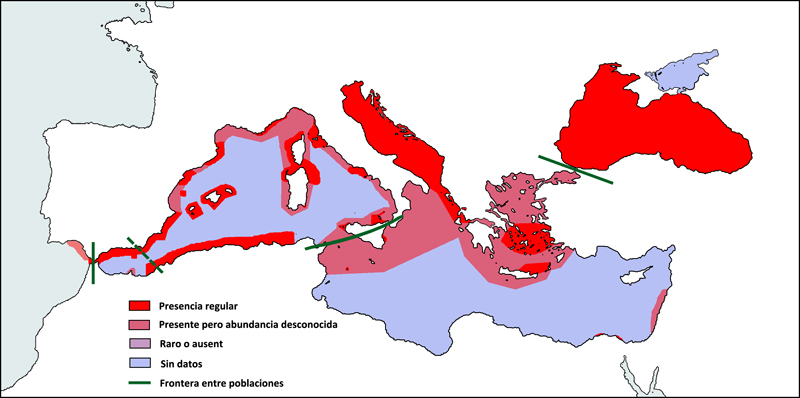
Estudis genètics basats en microsatèl·lits d’ADN i ADN mitocondrial suggereixen que hi hauria 3 poblacions a l’àrea mediterrània i del mar Negre, separades per barreres físiques (marcades amb línies verdes en el mapa inferior) (Natoli et al., 2005). Tot i això, les barreres no semblen restringir els moviments de l’espècie, sinó que delimitarien regions amb hàbitats diferents. Totes tres poblacions serien genèticament diferents dels individus que viuen a l’oceà Atlàntic nord-est. Així doncs, la frontera situada a l’estret de Màrmara separaria de forma clara les poblacions del mar Negre i la del Mediterrani oriental, la frontera formada per la península italiana i Sicília separaria, també de forma clara, les poblacions oriental i occidental del Mediterrani, i per últim, la frontera situada a l’estret de Gibraltar separaria, tot i que de manera menys clara, les poblacions del Mediterrani occidental i la de l’oceà Atlàntic. Aquesta última separació podria estar influenciada també pel front d’Almeria, que influiria sobre la distribució de preses del dofí mular.
El dofí mular està considerat com un depredador oportunista que presenta una dieta molt influïda per l’hàbitat en el que viuen els animals (Bearzi et al., 2008a). De fet, tant el comportament d’alimentació com la dieta varien en funció de l’àrea, l’estació de l’any, l’hàbitat, el nínxol ecològic que ocupen els individus d’aquella zona o fins i tot la demografia (Gannon & Waples 2004). Hi ha algun estudi que mostra diferències entre ecotipus costaners i els d’aigües més allunyades (Walker et al., 1999). En general es pot dir que les seves preses són majoritàriament espècies de peixos demersals com ara el lluç (Merluccius merluccius), el congre (Conger conger), el moll de fang (Mullus barbatus), el moll de roca (Mullus surmuletus), tot i que també pot alimentar-se d’alguns cefalòpodes com ara la sèpia europea (Sepia officinalis) o el pop roquer (Octopus vulgaris) (Bearzi et al., 2008). Tot i això, la dieta és altament variable i grups fins i tot molt propers, poden alimentar-se d’espècies diferents. Així doncs, només tenint en compte el Mediterrani, s’ha vist que hi ha diferències entre les diferents regions. A la mar Jònica s’alimenten sobretot d’espècies de peixos demersals (Bearzi et al., 2005a), al golf d’Amvrakikos (Grècia) la seva presa principal són peixos clupeids com ara la sardina (Sardina pilchardus) o l’alatxa (Sardinella aurita) (Bearzi et al., 2008b), al nord est del Mediterrani, la seva presa principal és el lluç (Merluccius merluccius) i alguns cefalòpodes (Blanco et al., 2001) i a la costa nord-est de Sardenya s’alimenten d’espècies salvatges com ara la llisa llobarrera (Mugil cephalus), la salpa (Sarpa salpa) i la sardina (Sardina pilchardus) que són atretes per les granges de peix (Díaz López, 2006a). De fet, aquestes últimes suposen també una font d’alimentació per al dofí mular, que s’alimenta dels peixos que s’hi crien, com ara el llobarro (Dicentrarchus labrax), la orada (Sparus aurata) i el corball de roca (Sciaena umbra) (Díaz López, 2006a).
En general es considera al dofí mular com una espècie que viu principalment en aigües costaneres, tot i que també se l’ha trobat en aigües pelàgiques, al voltant d’illes oceàniques o sobre la plataforma continental, especialment sobre el talús. Al mar Mediterrani els hàbitats en els que se’l troben varien força en funció de la regió. En aquest sentit se’l pot veure en zones costaneres en aigües poc profundes (menys de 50 metres) com ara al golf de Trieste (àrea que inclou aigües italianes, eslovenes i del nord d’Istria a Croàcia) (Genov et al., 2008), a la desembocadura del riu Po, al Mar Adriàtic nord-oest (Triossi et al., 2012) o al golf semi-tancat d’Amvrakikos a Grècia (Bearzi et al., 2008b). També se’l troba al voltant d’arxipèlags o illes del Mediterrani, en aigües de la plataforma i el talús continental (Forcada et al., 2004; Bearzi et al., 1997). En zones amb una alta abundància de cetacis, com ara el mar de Ligúria, se l’associa amb aigües de la plataforma continental fins als 200 metres de profunditat (Azzelino et al., 2008), mentre que en altres àrees molt productives, com ara el mar d’Alboran, sol ocupar aigües amb profunditats entre els 200 i 400 metres, evitant profunditats superiors a 600 metres (Cañadas et al., 2002; Cañadas & Hammond 2006).
La durada de l’embaràs és de més o menys 12 mesos i els parts presenten certa estacionalitat amb pics en els mesos de primavera i estiu. Els nounats seran totalment dependents de la mare durant aproximadament el mateix període de temps, durant el que la font d’aliment primària serà la llet materna. En molts casos la lactància por allargar-se durant uns anys més. El deslletament es sol produir quan les cries assoleixen els 18 – 20 mesos d’edat, tot i que la cria es pot quedar-se amb la mare fins als 6 anys. La separació entre tots dos es sol produir en el moment del naixement de la cria següent.
Les femelles assoleixen l’edat de maduresa sexual entre els 5 i els 13 anys i generalment hi arriben abans que els mascles, que ho fan entre els 9 i els 14. En aquest moment les femelles mesuren entre 220 i 235 cm, mentre que els mascles fan entre 245 i 260 cm. Si bé la taxa de creixement de les femelles és superior a la dels mascles durant les primeres etapes de vida, a l’edat dels 5 o 6 anys, la tendència s’inverteix (McFee et al., 2010). Les femelles seran també les primeres a arribar a la mida màxima, ho faran al voltant dels 10 anys, mentre que els mascles hi arriben entre els 10 i els 20 anys (Wells, 2003). Generalment les femelles poden arribar a viure un màxim de 57 anys mentre que l’edat màxima dels mascles és de 48.
La composició dels grups sol variar en funció de la regió, l’hàbitat que ocupen, la disponibilitat de preses o l’activitat, entre altres factors. En general es pot dir que els grups costaners són més petits, entre 2 i 20 individus, mentre que els que es troben en aigües pelàgiques estan formats per un nombre més gran d’animals (més de 1.000) (Shane et al., 1986; Perrin et al., 2009; Jefferson et al., 2008). El Mediterrani no és una excepció tot i que la majoria d’estudis realitzats han trobat grups petits. Així doncs, estudis realitzats a Grècia, Sardenya, el mar Adriàtic, les illes Balears, el Mar d’Alboran i per tota la conca Mediterrània, mostren que els grups estan formats majoritàriament per entre 1 i 15 individus, amb una mitjana de 7 animals, tot i que els grups més grans poden arribar a tenir 43 – 69 individus (Bearzi et al., 1997; Díaz López & Bernal Shirai, 2008; Díaz López et al., 2013; Forcada et al., 2004; Genov et al., 2008; Cañadas & Sagarminaga, 1994; Gannier, 2005; Gomez de Segura et al., 2006). Alguns estudis també han vist que els grups amb presència de cries solen ser més grans que els grups formats exclusivament per adults (Bearzi et al., 1997). Tot i que generalment no formen associacions amb altres espècies de cetacis, si que se’n poden produir en algunes àrees (Cañadas et al., 2002).
La composició del grup tendeix a ser dinàmica i es poden formar vàries unitats socials que inclouen grups de cria, grups juvenils i grups de mascles adults (Perrin et al., 2009; Shane et al., 1986). Els primers estarien formats per femelles en edat reproductiva i les seves cries, que poden romandre amb la mare entre 3 i 6 anys. Els segons serien grups força grans formats per mascles subadults o grups mixtes i que es mourien per la perifèria del rang de distribució. Les femelles poden romandre o tornar amb les seves mares durant certs períodes de temps, mentre que els mascles comencen a desenvolupar associacions molt properes amb altres mascles d’edat similar que perduraran en el temps (Wells, 2003). Per últim es poden formar grups de mascles, petits i generalment formats per individus únics o parelles. En aquest últim cas, són unions molt fortes que poden durar més de 20 anys. Aquests grups interactuarien amb agrupacions de femelles properes.
Es tracta d’una espècie activa tant durant el dia com durant la nit i que mostra una sèrie de comportaments aeris bastant extensa. Es freqüent veure’ls solcant les ones provocades per embarcacions o per grans balenes, donant cops amb l’aleta caudal o fent salts acrobàtics que poden arribar a ser mesurar varis metres d’alçada. És un molt bon nadador i les immersions solen durar entre 3 i 4 minuts en aigües costaneres i una mica més en aigües més profundes. Presenten, a més a més, una gran varietat de moviments d’alimentació entre els que s’hi inclouen la persecució a diferents velocitats, el fishwhacking en el que colpegen els peixos amb l’aleta caudal, l’acorralament de peixos a la vora de la platja avarant parcialment per capturar-los, la creació de bombolles per dirigir els peixos cap a la superfície o el kerplunking en el que dirigeixen els peixos mitjançant salts o cops amb l’aleta caudal.
És, juntament amb les orques (Orcinus orca), l’espècie que mostren un sistema de comunicació més desenvolupat. De fet produeixen tres tipus de senyals acústics. Clics d’ecolocalització, que utilitzarien en la navegació, l’alimentació i la detecció de depredadors; polsos que usen en algunes interaccions socials; i xiulets (Perrin et al., 2009). Aquests últims són específics de cada individu i permeten el seu reconeixement individual per la resta d’animals (Janik et al., 2006). A més a més, s’utilitzen majoritàriament quan es troben dos grups diferents al mar (Quick et al., 2012).
A la superfície es força fàcil diferenciar-lo gràcies a la seva aleta dorsal alta, falcada i de base ample; la seva mida, és més gran i més robust que les altres dues espècies de dofins més comuns al Mediterrani, el dofí llistat (Stenella coeruleoalba) i el dofí comú de musell curt(Delphinus delphis); i la coloració grisa del seu cos. Es pot arribar a confondre amb el cap d’olla gris (Grampus griseus), tot i que aquest últim no presenta un musell diferenciat, presenta moltes ferides al cos (sobretot els individus més vells) i sol ser més grans que el dofí mular.
Com en moltes altres espècies de cetacis, el dofí mular presenta característiques que, per la seva naturalesa única i durada prolongada, poden contribuir a la identificació de cada un dels individus d’una població. En aquest cas són 3 els caràcters que es poden utilitzar, tots ells situats a l’aleta dorsal (Würsig & Jefferson 1990):
Aquestes característiques són utilitzades en molts estudis de fotoidentificació. Per ser duts a terme amb èxit, s’han de produir albiraments d’individus ja vistos anteriorment i dels que se’n hagi pres alguna fotografia. També és important poder disposar de fotografies d’ambdós costats de l’aleta dorsal, ja que sinó es poden arribar a considerar com a individus diferents els dos costats (esquerra i dret) d’una mateixa aleta dorsal. A més a més, per assegurar la identificació positiva d’un individu vist amb anterioritat, és aconsellable poder reconèixer més d’una característica de les explicades anteriorment (Würsig & Jeferson 1990).
La UICN (Unió Internacional per a la Conservació de la Naturalesa) considera l’estatus de conservació global del dofí mular de preocupació menor, tot i que es desconeix la seva tendència poblacional. S’estima que la població mundial està formada per uns 600.000 individus (Perrin et al., 2009). L’oceà Pacífic és la zona amb poblacions més grans, on hi ha al voltant d’uns 226.200 individus al Pacífic est tropical (Wade, 1993), uns 168.000 al Pacífic nord-oest (Miyashita, 1993), uns 3.215 a les aigües que rodegen l’arxipèlg de Hawaii (Barlow, 2006) i uns 2.273 en aigües de Califòrnia, Oregón i Washington (Forney 2007). A l’oceà Atlàntic, els nombres no són tant grans, però s’estima que hi viurien uns 123.762 individus a la costa est d’Amèrica del Nord, al voltant d’uns 52.000 al golf de Mèxic, uns 12.600 a les costes atlàntiques europees i uns 1.000 al voltant de les Illes Faroe. La població del mar Negre s’estima en varis milers d’individus tot i que no se’n coneix el nombre exacte. Al mar Mediterrani no hi ha estimacions concretes, però estudis realitzats a l’oest de la conca han estimat la presència d’uns 7.654 individus al voltant de les Illes Balears (Forcada et al., 2004) i uns 584 al mar d’Alboran (Cañadas & Hammond 2006). Es creu que la població total estaria formada per uns 10.000 individus (Reeves et al., 2006) i que hauria disminuït considerablement durant les últimes dècades. Aquests fets han portat a la UICN a classificar l’estatus de conservació del dofí mular al Mediterrani de vulnerable. Les principals amenaces a les que ha de fer front l’espècie actualment són:
El dofí mular està protegit per diversos convenis internacionals com ara l’apèndix II del Conveni sobre el Comerç Internacional d’Espècies Amenaçades de Flora i Fauna Silvestres (CITES), per l’apèndix II de la Convenció d’Espècies Migratòries (CMS) o l’Acord sobre la Conservació dels Cetacis del mar Negre, Mediterrani i l’Àrea Atlàntica adjacent (ACCOBAMS). A més a més, estan protegits també per la legislació de molts dels països mediterranis. Aquesta protecció ha dut al desenvolupament de centenars d’Àrees Marines Protegides en diferents països, tot i que, per desgràcia, només n’hi ha una que hagi estat desenvolupada específicament per assegurar la protecció dels cetacis. Es tracta del Santuari Pelagos, situat al mar de Lígúria, creat a l’any 1999 i localitzat entre la costa nord de Còrsega i Itàlia.
Per assegurar la conservació d’aquesta espècie al Mediterrani és molt important que els estudis científics permetin ampliar els coneixements que es tenen sobre l’espècie, mitjançant estudis a més gran escala. La falta de coneixement pot ser molt perjudicial, ja que pot endarrerir l’adopció de mesures de conservació importants o afectar l’eficàcia de les ja existents (Bearzi et al., 2008). Cal però, que els governs dels diferents estats també hi contribueixin i que tinguin la voluntat política d’establir mesures per a mitigar les amenaces causades per l’acció humana (Bearzi et al., 2008).
AGUILAR, A. 2000. Population biology, conservation threats and status of Mediterranean striped dolphins (Stenella coeruleoalba). Journal of Cetacean Research and Management 2(1):17-26
AZZELINO, A., GASPARI, S., AIROLDI., S. & NANI, B. 2008. Habitat use and preferences of cetaceans along the continental slope and adjacent pelagic waters in the western Ligurian Sea. Deep-Sea Research. 55:296-323
BAIRD, R. W., GORGONE, A. M., McSWEENEY, D. J., LIGON, A. D., DEAKOS, M. H., WEBSTER, D. L., SCHORR, G. S. & MARTIEN, K. K. 2009. Population structure of island-associated dolphins: Evidence from photo-identification of common bottlenose dolphins (Tursiops truncatus) in the main Hawaiian islands. Marine Mammal Science. 25(2):251-274
BARLOW, J. 2006. Cetacean abundance in Hawaiian waters estimated from summer/fall survey in 2002. Marine Mammal Science. 22(2)446-464
BEARZI, G., NOTARBARTOLO DI SCIARA, G. & POLITI, E. 1997. Social ecology of bottlenose dolphins in the Kcarneric (northern Adriatic Sea). Marine Mammal Science. 13(4):650-668
BEARZI, G. 2002. Interactions between cetacean and fisheries in the Mediterranean Sea. In: G. Notarbartolo di Sciara (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 9, 20 p.
BEARZI, G. HOLCER, D. & NOTARBARTOLO DI SCIARA, G. 2004. The role of historical dolphin takes and habitat degradation in shaping the present status of norhtern Adriatic cetaceans. Aquatic Conservation: Marine and Freshwater Ecosystems. 13:363-379
BEARZI, G., POLITI, E., AGAZZI, S., BRUNO, S., COSTA, M. & BONIZZONI, S. 2005a. Occurrence and present status of coastal dolphins (Delphinus delphis and Tursiops truncatus) in the eastern ionian sea. Aquatic conservation: Marine and Freshwater Ecosustems. 15:243-257
BEARZI, G., FORTUNA, C., M. & RANDALL, R. R. 2008a. Ecology, status and conservation of common bottlenose dolphins Tursiops truncatus in the Mediterranean Sea. Mammal Review. 39(2):92-123
BEARZI, G., AGAZZI, S., BONIZZONI, S., COSTA, M. & AZZELINO, A. 2008b. Dolphins in a bottle: abundance, residency patterns and conservation of bottlenose dolphins Tursiops truncatus in the semi-enclosed eutrophic Amvrakikos Gulf, Greece. Aquatic conservation: Marine and Freshwater Ecosustems. 18:130-146
BELLANTE, A., SPROVIERI, M., BUSCAINO, G., BUFFA, G., DI STEFANO, V., SALVAGIO MANTA, D., BARRA, M., FILICIOTTO, F., BONANNO, A., GIACOMA, C. & MAZZOLA, S. 2012. Stranded cetaceans as indicators od mercury pollution in the Mediterranean Sea. Italian Jounral of Zoology. 79(1):151-160
BERGHAN, J., ALGIE, K. D., STOCKIN, K.A., WISEMAN, N., CONSTANTINE, R., TEZANOS-PINTO, G. & MOURÃO. 2008. A preliminary photo-identification study of bottlenose dolphin (Tursiops truncatus) in Harauki Gulf, New Zealand. New Zealand Journal of Marine and Freshwater Research. 42:465-472
BILANDZIC, N., SEDAK, M., DOKIC, M., DURAS GOMERCIC, M., GOMERCIC, T., ZADRAVEC, M., BENIC, M. & PREVENDAR CRNIC, A. 2012. Toxic elements concentrations in the bottlenose (Tursiops truncatus), striped (Stenella coeruleoalba) and risso’s (Grampus griseus) dolphins stranded in Eastern Adriatic Sea. Bulletin of Environmental Contamination and Toxicology. 89:467-473
BLANCO, C., SALOMÓN, O. & RAGA, J. A. 2001. Diet of the bottlenose dolphin (Tursiops truncatus) in the western Mediterranean Sea. Journal of the Marine Biology Association U.K. 81:1053-1058
BORRELL, A. & AGUILAR, A. 2007. Organochlorine concentrations declined during 1978 – 2002 in the western Mediterranean bottlenose dolphins, a coastal top predator. Cemosphere. 66:347-352
CAÑADAS, A. & SAGARMINAGA, R. 1994. Estudio de distribucion y dinamica de las poblaciones de cetáceos en las aguas del sud este español. Boletín del Instituto de Estudios Almerienses. 13:7-24
CAÑADAS, A., SAGARMINAGA, R. & GARCÍA-TISCAR, S. 2002. Cetacean distribution related with depth and slope in the Mediterranean watters of sothern Spain. Deep-Sea Research. I 49:2053-2073
CAÑADAS, A. & HAMMOND, P. S. 2006. Model-based abundance estimates for bottlenose dolphins off southern Spain: implications for conservation and management. Journal of Cetacean Research and Management. 8(1):13-27
CAWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
COLL, M. & LIBRALATO, S. 2012. Contributions of foodweb modelling for an ecosystem approach of marine resource management in the Mediterranean Sea. Fish and Fisheries 13:60–88
COLLET, A. 1984. Live-capture of cetaceans for European institutions. Report of the International Whaling Comission. 34:603-607
DEFRAN, R. H., SCHULTZ, G. M. & WELLER, D. W. 1990. A technique for the photographic identification and cataloging of dorsal fins of the bottlenose dolphin (Tursiops truncatus). Report of the International Whaling Comission. Special Issue 12:53-55
DI NATALE, A. & NOTARBARTOLO DI SCIARA, G. 1994. A review of the passive fishing nets and trap fisheries in the Mediterranean Sea and of cetacean bycatch. Report of the International Whaling Commission. Special issue 15:189-202
DÍAZ LÓPEZ, B. 2006(a). Bottlenose dolphin (Tursiops truncatus) predation on a marine fin fish farm: Some underwater observations. Aquatic Mammals. 32(3)305-310
DÍAZ LÓPEZ, B. 2006(b). Interactions between Mediterranean bottlenos dolphins (Tursiops truncatus) and gillnets of Sardinia, Italy. Journal of Marine Science. 63:946-951
DÍAZ LÓPEZ, B. & BERNAL SHIRAI, J. A. 2007. Bottlenose dolphin (Tursiops truncatus) presence and incidental capture in a marine fish farm on the north-eastern cost of Sardinia (Italy). Journal of the Marine Biological Association of the United Kingdom. 87:113-117
DÍAZ LÓPEZ, B. & BERNAL SHIRAI, J. A. 2008. Marine aquaculture and bottlenose dolphins’ (Tursiops truncatus) social structure. Behavioural Ecology and Sociobiology. 62:887-894
DÍAZ LÓPEZ, B., ALBERTO, A. & FRANCESCA, F. 2013. Ecology of common bottlenose dolphins along the north-western Sardinian coastal waters (Italy). Thalassas. 29(2):35-43
E. J. F. 2007. Illegal Driftnetting in the Mediterranean. Environmental Justice Foundation, London, UK.
FORCADA, J., GAZO, M., AGUILAR, A., GONZALVO, J. & FERNANDEZ-CONTRERAS, M. 2004. Bottlenose dolphin abundance in the NW Mediterranean: adressing heterogenity in distribution. Marine Ecology Progress Series. 275:275-287
FORNEY, K.A. 2007. Preliminary estimates of cetacean abundance along the U.S. west coast and within four National Marine Sanctuaries during 2005. U.S. Department of Commerce, NOAA Technical Memorandum NMFS-SWFSC-406. 27 p.
FOSSI, C. M., MARSILI, L., NERI, G., NATOLI, A., POLITI, E. & PANIGADA, S. 2003. The use of a non-lethal tool for evaluating toxicological hazard of organochlorine contaminants in the Mediterranean cetaceans: new data 10 years after the fist paper published in MPB. Marine Pollution Bulletin. 46:972-982
GANNIER, A. 2005. Summer distribution and relative abundance of delphinids in the Mediterranean Sea. Revue d’Écologie (Terre et Vie). 69:223-238
GANNON, D. P. & WAPLES, D. M. 2004. Diets of coastal bottlenose dolphins from the U.S. mid-Atlantic coast differ by habitat. Marine Mammal Science. 20(3):527-545
GENOV, T., KOTNJEK, P., LESJAK, J., HACE, A. & FORTUNA, C. M. 2008. Bottlenose dolphin (Tursiops truncatus) in slovenjan and adjacent waters (northern Adriatic Sea). Annales, Series Historia Naturalis. 18(2):227-244
GÓMEZ DE SEGURA, A., CRESPO, E. A., PEDRAZA, S. N., HAMMOND, P. S. & RAGA, J. A. 2006. Abundance of small cetaceans in waters of the central spanish Mediterranean. Marine Biology 150:149-160
IUCN 2012. Marine Mammals and Sea Turtles of the Mediterranean and Black Seas. Gland, Switzerland and Malaga, Spain: IUCN. 32 pages.
JANIK, V. M., SAYIGH, L. S. & WELLS, R. S. 2006. Signature whistle shape conveys identity information to bottlenose dolphins. Proceedings of the National Academy of Sciences. 103:8293-8297
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
KASUYA, T., TOBAYAMA, T. & MATSUI, S. 1984. Review of the Live-capture of small cetaceans in Japan. Report of the International Whaling Comission. 34:597-602
LAHAYE, V., BUSTAMANTE, P., DABIN, W., VAN CANNEYT, O., DHERMIAN, F., CESARINI, C., PIERCE, G. J. & CAURANT, F. 2006. New insights from age determination on toxic element accumulation in striped and bottlenose dolphins from Atlantic and Mediterranean waters. Marine Pollution Bulletin. 52:1219-1230
LLEONART, J. 2005. Mediterranean and Black Sea. In: Review of the state of the world marine fishery resources. FAO Fisheries Technical Paper 457, FAO UN:49-64
LOCKYER, C. H. & MORRIS, R. J. 1990. Some observations on wound healing and persistence of scars in Tursiops truncatus. Report of the International Whaling Comission. Special Issue 12:113-118
McFEE, W. E., SCHWACKE, J. H., STOLEN, M. K., MULLIN, K. D. & SCHWACKE, L. H. 2010. Investigation of growth phases for bottlenose dolphins using a Bayesian modeling approach. Marine Mammal Science. 26(1):67-85
MIYASHITA, T. 1993. Abundance of dolphin stocks in the western North Pacific taken by the Japanese drive fishery. Report of the International Whaling Comission. 43:417-437
NATOLI, A. 2004. Molecular ecology of bottlenose (Tursiops sp.) and common (Delphinus sp.) dolphins. PhD thesis, University of Durham
NATOLI A., BIRKUN, A., AGUILAR, A., LOPEZ, A. & HOELZEL, A. R. 2005. Habitat structure and the dispersal of male and female bottlenose dolphins (Tursiops truncatus). Proceeding of the Royal Society. 272:1217-1226
PERRIN, W. F. & REILLY, S. 1984. Reproductive parameters of dolphins and small whales of the family Delphinidae. Report of the International Whaling Comission. (Special Issue 6):97-133
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
QUICK, N. J. & JANIK, V. M. 2012. Bottlenose dolphins exchange signature whistles when meeting at sea. Proceedings of the Royal Society. 279:2539-2545
REIJNDERS, P. J. H. 1998. Reproductive and Developmental Effects of Endocrine-Disrupting Chemicals on Marine Mammals. in In: T.J. O’Shea, R.R. Reeves & A. Kirk Long (eds.) 1998. Marine mammals and persistent ocean contaminants: proceedings of the Marine Mammal Commission workshop, Keystone, Colorado. Marine Mammmal Commission, 1999, pp.93-100
REEVES, R. R., SMITH, B. D., CRESPO E. & NOTARBARTOLO DI SCIARA. 2003. Dolphins, Whales and Porpoises: 2000-2010 Conservation Action Plan for the World’s Cetaceans. IUCN, Gland, Switzerland. 139 pp.
REEVES, R. R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 64 pp.
SHANE, S. H., WELLS, R. S. & WÜRSIG, B. 1986. Ecology, behaviour and social organization of the bottlenose dolphin: A review. Marine Mammal Science. 2(1):34-63
SHIRIHAI, H. & JARRET, B. 2006. Whales dolphins and seals: A field guide to marine mammals of the world. First edition. A&C Black. London
TRIOSSI, F., WILLIS, T. J. & PACE, D. S. 2012. Occurrence of bottlenose dolphins Turiops truncatus in natural gas fields of the northwestern Adriatic Sea. Marine Ecology. 34:373-379
WADE, R., P. & GERRODETTE, T. 1993. Estimates of cetacean abundance and distribution in the Eastern Tropical Pacific. Report of the International Whaling Comission. 43:477-493
WALKER, J. L., POTTER, C. W. & MACKO, S. A. 1999. The diets of modern and historic bottlenose dolphins populations reflected through stable isotopes. Marine Mammal Science. 15(2):335-350
WEIR, R. C., CANNING, S., HEPWORTH, K., SIM, I. & STOCKIN, K. A. 2008. A long-term opportunistic photo-identification study of bottlenose dolphins (Tursiops truncatus) off Aberdeen, United Kingdom: Conservation Value and Limitations. Aquatic Mammals. 34(4):436-447
WELLS, R. S. & SCOTT, M. D. 1990. Estimating bottlenose dolphinpopulation parameters from individual identification and capture-release techniques. Report of the International Whaling Comission. Special Issue 12:407-415
WELLS, R. S. 2003. Dolphin social complexity: Lessons from long-term study and life history. In “Animal Social Complexity: Intelligence, Culture, and Individualized Societies” (DE WAAL, F., B., M., & TYACK, P., L., eds), pp. 32–56. Harvard University Press, Cambridge.
WÜRSIG, B. & JEFFERSON, T. 1990. Methods of photo-identification for small cetaceans. Report of the International Whaling Comission. Special Issue 12:43-52
http://www.iucnredlist.org/details/22563/0
http://www.iucnredlist.org/details/16369383/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/
AVÍS LEGAL – Copyright © 2021 Tots els drets reservats.