
Se puede confundir con: Calderón gris
Heridas en parte dorsal
Patrón de natación:
![]()
![]()
El delfín mular (Tursiops truncatus) es un cetáceo que pertenece a la familia delphinidae dentro del orden de los odontocetos. Es seguramente uno de los cetáceos más conocidos ya que es de los más comunes en los delfinarios de todo el mundo y en el cine o la televisión. Se trata de un delfín grande, bastante robusto con un hocico más bien corto y grueso, separado claramente del melón. La aleta dorsal, que es alta, de base ancha, falcada y con la punta puntiaguda, está situada en posición bastante centrada. Las aletas pectorales son moderadamente largas, finas oscuras y con las puntas un poco puntiagudas.
Presenta una coloración bastante monocromática y poco diferenciada, siendo las partes dorsales y laterales más bien oscuras (aunque pueden variar desde gris claro hasta casi negro) y la parte ventral blanca, a veces con tonalidades rosáceas. Algunos ejemplares pueden presentar una marca más clara y alargada desde la parte superior de las aletas pectorales hasta la zona de la capa, anterior a la aleta dorsal.
Presenta entre 36 y 54 dientes puntiagudas en ambas mandíbulas. Los animales adultos pas pueden tener bastante gastadas o incluso ausentes.
Es una de las especies de la família delphinidae que presenta ejemplares más grandes. Su tamaño máximo varia en función de la región y, aparentemente, lo hace de forma inversamente proporcional a al temperatura. En general pueden llegar a medir entre 1,9 y 4,1 metros, siendo los machos ligeramente más largos que las hembras. Los individuos más grandes están en el Atlántico noreste, alrededor del Reino Unido. Su tamaño al nacer oscila entre los 85 centímetros y los 1,4 metros. Su peso máximo puede llegar a los 650 kg, a pesar de que generalmente pesan bastante menos.
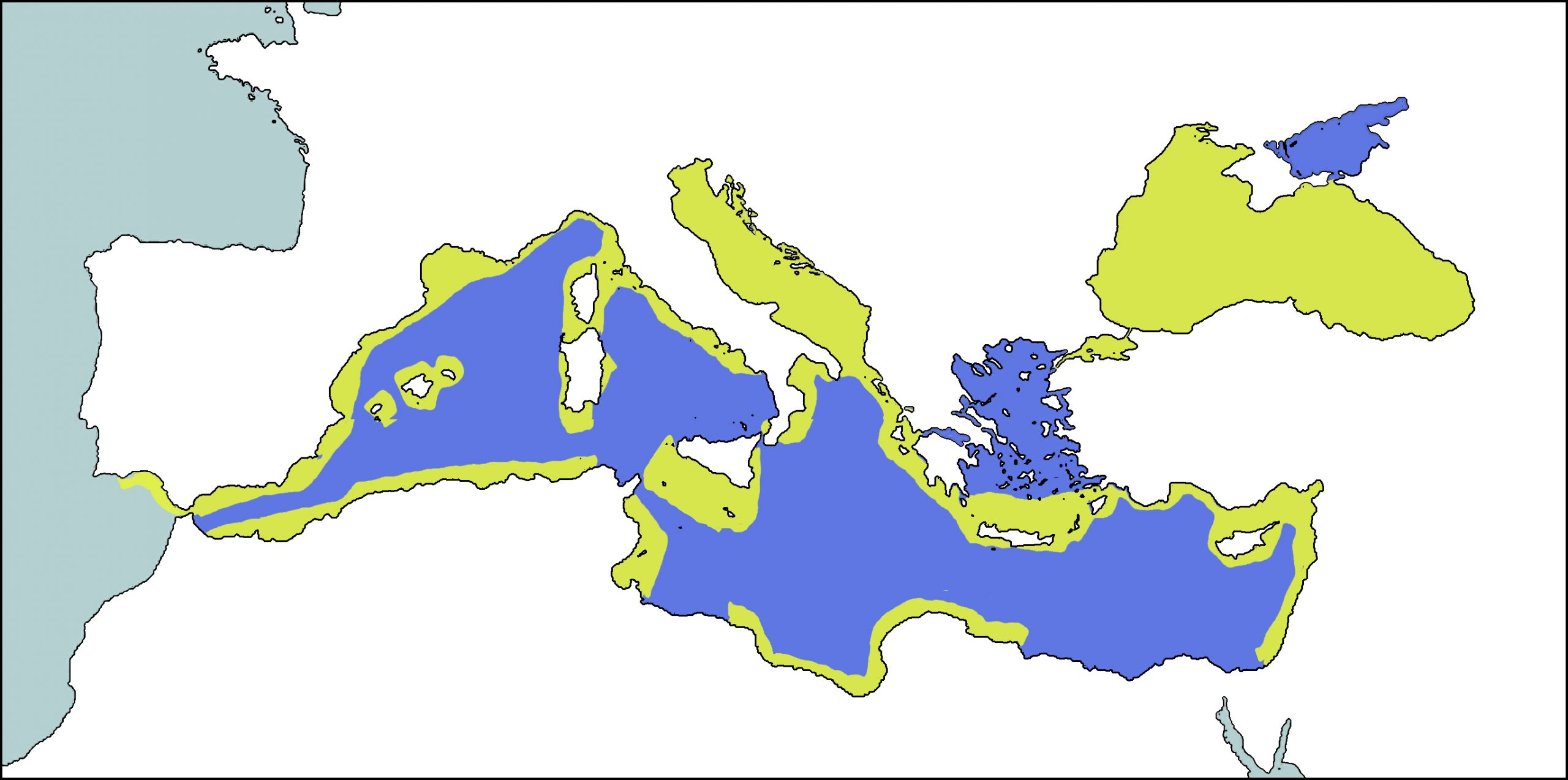
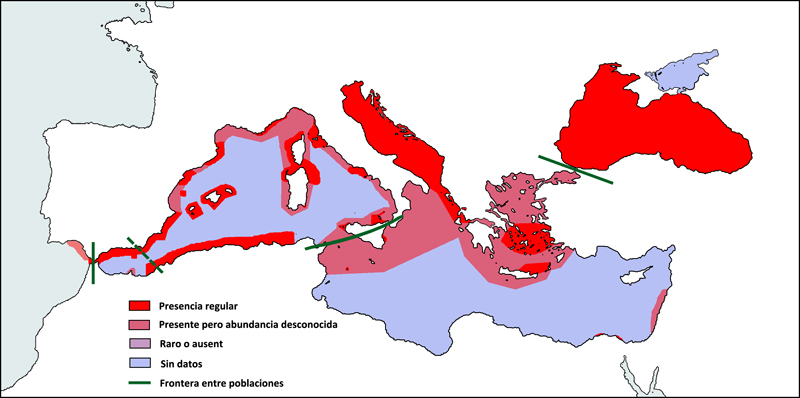
El delfín mular es una especie distribuida ampliamente por todo el planeta, pero especialmente en aguas costeras y en la plataforma continental de las regiones tropicales y templadas. En el Mediterráneo, se cree que era una especie que se distribuía de forma continua por sus aguas costeras. En la actualidad, sigue siendo más abundante en las aguas cercanas a la costa, sobretodo aquellas situadas encima la plataforma continental y más raramente en zona más pelágicas, aunque su distribución está más fragmentada (Reeves & Notarbartolo di Sciara, 2006). Ha sido avistado por toda la cuenca mediterránea, desde el estrecho de Gibraltar hasta los Dardanelos, sobretodo en la parte norte, donde se ha estudiado con mayor profundidad, aunque también se le ha detectado en la costa de Túnez y otras zonas de la costa norte de África. También es frecuente en archipiélagos como el de las Baleares e islas como Córcega, Cerdeña o Sicilia (Forcada et al, 2004; Bearzi, et al, 2008a). Es abundante en el mar Negro, en el Adriático, en ciertas zonas del mar Egeo, en las costas norte y oeste de Córcega y Cerdeña, en la costa de Argelia y en ciertas áreas de las costas catalanas y del sud de la península Ibérica.
Estudios genéticos basados en microsatélites de ADN y ADN mitocondrial sugieren que habría 3 poblaciones en el área mediterránea y el mar Negro, separadas por barreras físicas (marcadas con línias verdes en el mapa inferiori) (Natoli et al., 2005). A pesar de todo, parece ser que las barreras no restringen los movimientos de la especie, sino que delimitarían regiones con hábitats diferentes. Las tres poblaciones serían genéticamente diferentes de los individuos que viven en el oceáno Atlántico noreste. Así pues, la frontera situada en el estrecho de Mármara, separaría de forma clara las poblaciones del mar Negro y la del Mediterráneo oriental,la frontera formada por la península italiana y Sicilia separaría, también de forma clara, las poblaciones oriental y occidental del Mediterráneo, y por último, la frontera situada en el estrecho de Gibraltar separaría, aunque de manera menos clara, las poblaciones del Mediterráneo occidental y la del océano Atlántico. Esta última separación podría estar influenciada también por el frente de Almería, que a su vez infuiría sobre las distribución de las presas del delfín mular.
El delfín mular está considerado como un depredador oportunista que presenta una dieta muy influenciada por el hábitat en el que viven los animales (Bearzi et al., 2008a). De hecho, tanto el comportamiento de alimentación como la dieta varían en función del área, la estación del año, el hábitat, el nicho ecológico que ocupan los individuos de aquella zona e incluso la demografía (Gannon & Waples 2004). Hay algún estudio que muestra diferencias entre ecotipos costeros y los de aguas más alejadas (Walker et al., 1999). En general se puede decir que sus presas son mayoritariamente especies de peces demersales como la merluza (Merluccius merluccius), el congrio (Conger conger), el salmonete de fango (Mullus barbatus), el salmonete de roca (Mullus surmuletus), aunque también pueden alimentarse de algunos cefalópodos como la sepia común (Sepia officinalis) o el pulpo común (Octopus vulgaris) (Bearzi et al., 2008). A pesar de todo, la dieta es altamente variable e incluso grupos muy cercanos pueden alimentarse de especies distintas. Así pues, teniendo en cuenta únicamente el Mediterráneo, se ha visto que hay diferencias entre las distintas regiones. En el mar Jónico se alimentan sobretodo de especies de peces demersales (Bearzi et al., 2005a), en el golfo de Amvrakikos (Grècia) su principal presa son los peces de la família clupeidae como la sardina (Sardina pilchardus) o la alacha (Sardinella aurita) (Bearzi et al., 2008b), en el noreste del Mediterráneo, su principal presa es la merluza (Merluccius merluccius) y algunos cefalópodos (Blanco et al., 2001) y en la costa noreste de Cerdeña se alimentan de especies silvestres como la llisa (Mugil cephalus), la salpa (Sarpa salpa) y la sardina (Sardina pilchardus) que son atraídas por las granjas de pescado (Díaz López, 2006a). De hecho, estas últimas también suponen una fuente de alimentación para el delfín mular, que se alimenta de los peces que en ellas se crían, como la lubina (Dicentrarchus labrax), la dorada (Sparus aurata) y la corvina negra (Sciaena umbra) (Díaz López, 2006a).
En general se considera al delfín mular como una especie que vive principalmente en aguas costeras, aunque también se le ha visto en aguas pelágicas, alrededor de islas oceánicos o encima de la plataforma continental, especialmente sobre el talud. En el Mediterráneo, los hábitats en los que lo encontramos varían bastante en función de la región. En este sentido se le puede ver en zonas costeras poco profundas (menos de 50 metros) como en el golfo de Trieste (área que incluye aguas italianas, eslovenas y del norte de Istria en Croacia) (Genov et al., 2008), en la desembocadura del río Po, en el Mar Adriático noroeste (Triossi et al., 2012) o en el golf semicerrado de Amvrakikos en Grècia (Bearzi et al., 2008b). También se lo puede encontrar alrededor de archipiélagos o islas del Mediterráneo, en aguas de la plataforma i el talud contintentales (Forcada et al., 2004; Bearzi et al., 1997). En zonas con una abundancia de cetáceos alta, como el mar de Liguria, se le asocia con aguas de la plataforma continental, hasta 20 metros de profundidad (Azzelino et al., 2008), mientras que en áreas muy productivas, como el mar de Alborán, suele ocupar aguas con profundidades entre los 200 y los 400 metros, evitando profundidades superiores a 600 metros (Cañadas et al., 2002; Cañadas & Hammond 2006).
La duración del embarazo es de más o menos 12 meses y los partos presentan cierta estacionalidad con picos en los meses de primavera y verano. Los neonatos serán completamente dependientes de la madre durante aproximadamente el mismo periodo de tiempo, durante el cual, la fuente de alimentación primaria será la leche materna. En muchos casos la lactancia puede alargarse durante un año más. El destete se suele producir cuando las crías alcanzan los 18 – 20 meses de edad, aunque la cría puede quedarse con la madre hasta los 6 años. La separación entre los dos se suele producir en el momento del nacimiento de la cría siguiente.
Las hembras alcanzan la madurez sexual entre los 5 y los 13 años y generalmente lo hacen antes que los machos, que lo hacen entre los 9 y los 14. En este momento, las hembras miden entre 220 i 235 cm, mientras que los machos miden entre 245 y 260 cm. Aunque la tasa de crecimiento de las hembras es superior a la de los machos durante las primeras etapas de vida, a la edad de los 5 o 6 años, la tendencia se invierte (McFee et al., 2010). Las hembras también son las primeras en alcanzar el tamaño máximo, alrededor de los 10 años, mientras que los machos lo alcanzan entre los 10 y los 20 años (Wells, 2003). Generalmente las hembras pueden vivir un máximo de 57 años, mientras que la edad máxima de los machos es de 48.
La composición de los grupos suele variar en función de la región, el hábitat que ocupan, la disponibilidad de presas o la actividad, entre otros factores. En general se puede decir que los grupos costeros son más pequeños, entre 32 i 20 individuos, mientras que los que se encuentran en aguas pelágicas están formado por un número mayor de animales (más de 1.000) (Shane et al., 1986; Perrin et al., 2009; Jefferson et al., 2008). El Mediterráneo no es una excepción, aunque la mayoría de estudios realizados han encontrado grupos pequeños. Así pues, estudios realizados en Grecia, Cerdeña, el mar Adriático, las islas Baleares, el mar de Alborán y por toda la cuenca Mediterránea, muestran que los grupos están formados mayoritariamente por entre 1 y 15 individuos, con una media de 7 animales, aunque los grupos más grandes pueden llegar a tener entre 43 y 69 individuos (Bearzi et al., 1997; Díaz López & Bernal Shirai, 2008; Díaz López et al., 2013; Forcada et al., 2004; Genov et al., 2008; Cañadas & Sagarminaga, 1994; Gannier, 2005; Gomez de Segura et al., 2006). Algunos estudios también han visto que los grupos con presencia de crías suelen ser más grandes que los grupos formados exclusivamente por adultos (Bearzi et al., 1997). Aunque generalmente no forman asociaciones con otras especies de cetáceos, si que se pueden producir en algunas áreas (Cañadas et al., 2002).
La composición del grupo tiende a ser dinámica y se pueden formar varias unidades sociales que incluyen grupos de cría, grupos juveniles y grupos de machos adultos (Perrin et al., 2009; Shane et al., 1986). Los primeros estarían formados por hembras en edad reproductiva y sus crías, que pueden permanecer con la madre entre 3 y 6 años. Los segundos serían grupos bastante grandes formados por machos subadultos o grupos mixtos y que se moverían por la periferia del rango de distribución. Las hembras pueden permanecer o volver con sus madres durante ciertos periodos de tiempo, mientras que los machos empiezan a desarrollar asociaciones muy cercanas con otros machos de edad similar que perdurarán en el tiempo (Wells, 2003). Por último pueden formar grupos de machos, pequeños y generalmente formados por individuos únicos o parejas. En este último caso, son uniones muy fuertes que pueden durar más de 20 años. Estos grupos interactuarían con agrupaciones de hembras cercanas.
Se trata de una especie activa tanto durante el día como durante la noche y que muestra una serie de comportamientos aéreos bastante extensa. Es frecuente verlos surcar las olas provocadas por embarcaciones o por grandes ballenas, dando golpes con la aleta caudal o realizando saltos acrobáticos que pueden medir varios metros de altura. Es un muy buen nadador y las inmersiones suelen durar entre 3 y 4 minutos en aguas costeras y un poco más en aguas más profundas. Presentan también una gran variedad de movimientos de alimentación entre los que se incluyen la persecución a distintas velocidades, el fishwhacking en el que golpean a los peces con la aleta caudal, el acorralamiento de peces en la orilla de la playa varando parcialmente para capturarlos, la creación de burbujas para dirigir los peces hacia la superficie o el kerplunking en el que dirigen los peces mediante saltos o golpes con la aleta caudal.
Es, junto a las orcas (Orcinus orca), la especie que muestra un sistema de comunicación más desarrollado. De hecho producen tres tipos de señales acústicos. Clics de ecolocalización, que se utilizarían en la navegación, la alimentación y la detección de depredadores; pulsos que se usan en algunas interacciones sociales; y silbidos (Perrin et al., 2009). Estos últimos son específicos de cada individuo y permiten su reconocimiento individual por el resto de animales (Janik et al., 2006). Además, se utilizan mayoritariamente cuando se encuentran dos grupos en el mar (Quick et al., 2012).
En la superficie es bastante fácil diferenciarlo gracias a su aleta dorsal alta falcada y de base ancha; su tamaño, es más grande y más robusto que las otras dos especies de delfines más comunes en el Mediterráneo, el delfín listado (Stenella coeruleoalba) i el delfín común de hocico corto (Delphinus delphis); y la coloración gris de su cuerpo. Se puede confundir con el calderón gris (Grampus griseus), aunque este último no presenta un hocico diferenciado, presenta muchas heridas en el cuerpo (sobretodo los individuos más viejos) y suele ser más grandes que el delfín mular.
Como en muchas otras especies de cetáceos, el delfín mular presenta características que, por su naturaleza única y duración prolongada, pueden contribuir a la identificación de cada uno de los individuos de una población. En este caso son 3 los caracteres que se pueden utilizar, todos ellos situados en la aleta dorsal (Würsig & Jefferson 1990):
Estas características son utilizadas en muchos estudios de fotoidentificación. Para ser llevados a cabo con éxito, se tiene que producir avistamientos de individuos ya vistos anteriormente y de los que se haya tomado alguna fotografía. También es importante poder disponer de fotografías de ambos lados de la aleta dorsal, ya que sino, se pueden considerar como individuos distintos los dos lados (derecho e izquierdo) de una misma aleta dorsal. Además, para asegurar la identificación positiva de un individuo visto con anterioridad, es aconsejable poder reconocer más de una característica de las explicadas anteriormente (Würsig & Jeferson 1990).
La UICN (Unión Internacional para la Conservación de la Naturaleza) considera el estatus de conservación global del delfín mular de preocupación menor, aunque se desconoce su tendencia poblacional. Se estima que la población mundial está formada por unos 600.000 individuos (Perrin et al., 2009). El océano Pacífico es la zona con poblaciones más grandes, donde hay alrededor de 226.200 individuos en el Pacífico este tropical (Wade, 1993), unos 168.000 en el Pacífico noroeste (Miyashita, 1993), unos 3.215 en las aguas que rodean el archipiélago de Hawaii (Barlow, 2006) y unos 2.273 en aguas de California, Oregón y Washington (Forney 2007). En el océano Atlántico, los números no son tan grandes, pero se estima que vivirían unos 123.762 individuos en la costa este de Norteamérica, alrededor de unos 52.000 en el golfo de Méjico, unos 12.600 en las costas atlánticas europeas y unos 1.000 alrededor de las Islas Faroe. La población del Mar Negro se estima en varios miles de individuos aunque no se conoce el número exacto. En el Mediterráneo no hay estimaciones concretas, pero estudios realizados en el oeste de la cuenca han estimado la presencia de unos 7.654 individuos alrededor de las Islas Baleares (Forcada et al., 2004) y unos 584 en el mar de Alborán (Cañadas & Hammond 2006). Se cree que la población total estaría formada por unos 10.000 individuos (Reeves et al., 2006) y que habría disminuido considerablemente durante las últimas décadas. Estos hechos han llevado a la UICN a clasificar el estatus de conservación del delfín mular en el Mediterráneo de vulnerable. Las principales amenazas a las que tiene que hacer frente la especie actualmente son:
El delfín mular está protegido por diversos convenios internacionales como por ejemplo el apéndice II del Convenio dobre el Comercio Internacional de Especies Amenazadas de Flora y Fauna Silvestres (CITES), por el apéndice II de la Convención de Especies Migratorias (CMS) o el Acuerdo sobre ala Conservación de los Cetáceos del Mar Negro, Mediterráneo y el Área Atlántica adyacente (ACCOBAMS). Además estan protegidos también por la legislación de muchos de los países mediterráneos. Esta protección ha conllevado el desarrollo de centenares de Áreas Marinas Protegidas en distintos países, aunque, por desgracia, sólo hay una que haya sido desarrollada específicamente para asegurar la protección de los cetáceos. Se trata del Santuario Pelagos, situado en el mar de Liguria, creado en el año 1999 y localizado entre la costa norte de Córcega e Italia.
Para asegurar la conservación de esta especie en el Mediterráneo es muy importante que los estudios científicos permitan ampliar los conocimientos que se tiene sobre la especie, mediante estudios a mayor escala. La falta de conocimiento puede ser muy perjudicial, ya que puede retrasar la adopción de medidas de conservación importantes o afectar a la eficacia de las ya existentes (Bearzi et al., 2008). Es necesario pero, que los diferentes estados contribuyan y tengan la voluntad política de establecer medidas para mitigar las amenazas causadas por la acción humana (Bearzi et al., 2008).
AGUILAR, A. 2000. Population biology, conservation threats and status of Mediterranean striped dolphins (Stenella coeruleoalba). Journal of Cetacean Research and Management 2(1):17-26
AZZELINO, A., GASPARI, S., AIROLDI., S. & NANI, B. 2008. Habitat use and preferences of cetaceans along the continental slope and adjacent pelagic waters in the western Ligurian Sea. Deep-Sea Research. 55:296-323
BAIRD, R. W., GORGONE, A. M., McSWEENEY, D. J., LIGON, A. D., DEAKOS, M. H., WEBSTER, D. L., SCHORR, G. S. & MARTIEN, K. K. 2009. Population structure of island-associated dolphins: Evidence from photo-identification of common bottlenose dolphins (Tursiops truncatus) in the main Hawaiian islands. Marine Mammal Science. 25(2):251-274
BARLOW, J. 2006. Cetacean abundance in Hawaiian waters estimated from summer/fall survey in 2002. Marine Mammal Science. 22(2)446-464
BEARZI, G., NOTARBARTOLO DI SCIARA, G. & POLITI, E. 1997. Social ecology of bottlenose dolphins in the Kcarneric (northern Adriatic Sea). Marine Mammal Science. 13(4):650-668
BEARZI, G. 2002. Interactions between cetacean and fisheries in the Mediterranean Sea. In: G. Notarbartolo di Sciara (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 9, 20 p.
BEARZI, G. HOLCER, D. & NOTARBARTOLO DI SCIARA, G. 2004. The role of historical dolphin takes and habitat degradation in shaping the present status of norhtern Adriatic cetaceans. Aquatic Conservation: Marine and Freshwater Ecosystems. 13:363-379
BEARZI, G., POLITI, E., AGAZZI, S., BRUNO, S., COSTA, M. & BONIZZONI, S. 2005a. Occurrence and present status of coastal dolphins (Delphinus delphis and Tursiops truncatus) in the eastern ionian sea. Aquatic conservation: Marine and Freshwater Ecosustems. 15:243-257
BEARZI, G., FORTUNA, C., M. & RANDALL, R. R. 2008a. Ecology, status and conservation of common bottlenose dolphins Tursiops truncatus in the Mediterranean Sea. Mammal Review. 39(2):92-123
BEARZI, G., AGAZZI, S., BONIZZONI, S., COSTA, M. & AZZELINO, A. 2008b. Dolphins in a bottle: abundance, residency patterns and conservation of bottlenose dolphins Tursiops truncatus in the semi-enclosed eutrophic Amvrakikos Gulf, Greece. Aquatic conservation: Marine and Freshwater Ecosustems. 18:130-146
BELLANTE, A., SPROVIERI, M., BUSCAINO, G., BUFFA, G., DI STEFANO, V., SALVAGIO MANTA, D., BARRA, M., FILICIOTTO, F., BONANNO, A., GIACOMA, C. & MAZZOLA, S. 2012. Stranded cetaceans as indicators od mercury pollution in the Mediterranean Sea. Italian Jounral of Zoology. 79(1):151-160
BERGHAN, J., ALGIE, K. D., STOCKIN, K.A., WISEMAN, N., CONSTANTINE, R., TEZANOS-PINTO, G. & MOURÃO. 2008. A preliminary photo-identification study of bottlenose dolphin (Tursiops truncatus) in Harauki Gulf, New Zealand. New Zealand Journal of Marine and Freshwater Research. 42:465-472
BILANDZIC, N., SEDAK, M., DOKIC, M., DURAS GOMERCIC, M., GOMERCIC, T., ZADRAVEC, M., BENIC, M. & PREVENDAR CRNIC, A. 2012. Toxic elements concentrations in the bottlenose (Tursiops truncatus), striped (Stenella coeruleoalba) and risso’s (Grampus griseus) dolphins stranded in Eastern Adriatic Sea. Bulletin of Environmental Contamination and Toxicology. 89:467-473
BLANCO, C., SALOMÓN, O. & RAGA, J. A. 2001. Diet of the bottlenose dolphin (Tursiops truncatus) in the western Mediterranean Sea. Journal of the Marine Biology Association U.K. 81:1053-1058
BORRELL, A. & AGUILAR, A. 2007. Organochlorine concentrations declined during 1978 – 2002 in the western Mediterranean bottlenose dolphins, a coastal top predator. Cemosphere. 66:347-352
CAÑADAS, A. & SAGARMINAGA, R. 1994. Estudio de distribucion y dinamica de las poblaciones de cetáceos en las aguas del sud este español. Boletín del Instituto de Estudios Almerienses. 13:7-24
CAÑADAS, A., SAGARMINAGA, R. & GARCÍA-TISCAR, S. 2002. Cetacean distribution related with depth and slope in the Mediterranean watters of sothern Spain. Deep-Sea Research. I 49:2053-2073
CAÑADAS, A. & HAMMOND, P. S. 2006. Model-based abundance estimates for bottlenose dolphins off southern Spain: implications for conservation and management. Journal of Cetacean Research and Management. 8(1):13-27
CAWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
COLL, M. & LIBRALATO, S. 2012. Contributions of foodweb modelling for an ecosystem approach of marine resource management in the Mediterranean Sea. Fish and Fisheries 13:60–88
COLLET, A. 1984. Live-capture of cetaceans for European institutions. Report of the International Whaling Comission. 34:603-607
DEFRAN, R. H., SCHULTZ, G. M. & WELLER, D. W. 1990. A technique for the photographic identification and cataloging of dorsal fins of the bottlenose dolphin (Tursiops truncatus). Report of the International Whaling Comission. Special Issue 12:53-55
DI NATALE, A. & NOTARBARTOLO DI SCIARA, G. 1994. A review of the passive fishing nets and trap fisheries in the Mediterranean Sea and of cetacean bycatch. Report of the International Whaling Commission. Special issue 15:189-202
DÍAZ LÓPEZ, B. 2006(a). Bottlenose dolphin (Tursiops truncatus) predation on a marine fin fish farm: Some underwater observations. Aquatic Mammals. 32(3)305-310
DÍAZ LÓPEZ, B. 2006(b). Interactions between Mediterranean bottlenos dolphins (Tursiops truncatus) and gillnets of Sardinia, Italy. Journal of Marine Science. 63:946-951
DÍAZ LÓPEZ, B. & BERNAL SHIRAI, J. A. 2007. Bottlenose dolphin (Tursiops truncatus) presence and incidental capture in a marine fish farm on the north-eastern cost of Sardinia (Italy). Journal of the Marine Biological Association of the United Kingdom. 87:113-117
DÍAZ LÓPEZ, B. & BERNAL SHIRAI, J. A. 2008. Marine aquaculture and bottlenose dolphins’ (Tursiops truncatus) social structure. Behavioural Ecology and Sociobiology. 62:887-894
DÍAZ LÓPEZ, B., ALBERTO, A. & FRANCESCA, F. 2013. Ecology of common bottlenose dolphins along the north-western Sardinian coastal waters (Italy). Thalassas. 29(2):35-43
E. J. F. 2007. Illegal Driftnetting in the Mediterranean. Environmental Justice Foundation, London, UK.
FORCADA, J., GAZO, M., AGUILAR, A., GONZALVO, J. & FERNANDEZ-CONTRERAS, M. 2004. Bottlenose dolphin abundance in the NW Mediterranean: adressing heterogenity in distribution. Marine Ecology Progress Series. 275:275-287
FORNEY, K.A. 2007. Preliminary estimates of cetacean abundance along the U.S. west coast and within four National Marine Sanctuaries during 2005. U.S. Department of Commerce, NOAA Technical Memorandum NMFS-SWFSC-406. 27 p.
FOSSI, C. M., MARSILI, L., NERI, G., NATOLI, A., POLITI, E. & PANIGADA, S. 2003. The use of a non-lethal tool for evaluating toxicological hazard of organochlorine contaminants in the Mediterranean cetaceans: new data 10 years after the fist paper published in MPB. Marine Pollution Bulletin. 46:972-982
GANNIER, A. 2005. Summer distribution and relative abundance of delphinids in the Mediterranean Sea. Revue d’Écologie (Terre et Vie). 69:223-238
GANNON, D. P. & WAPLES, D. M. 2004. Diets of coastal bottlenose dolphins from the U.S. mid-Atlantic coast differ by habitat. Marine Mammal Science. 20(3):527-545
GENOV, T., KOTNJEK, P., LESJAK, J., HACE, A. & FORTUNA, C. M. 2008. Bottlenose dolphin (Tursiops truncatus) in slovenjan and adjacent waters (northern Adriatic Sea). Annales, Series Historia Naturalis. 18(2):227-244
GÓMEZ DE SEGURA, A., CRESPO, E. A., PEDRAZA, S. N., HAMMOND, P. S. & RAGA, J. A. 2006. Abundance of small cetaceans in waters of the central spanish Mediterranean. Marine Biology 150:149-160
IUCN 2012. Marine Mammals and Sea Turtles of the Mediterranean and Black Seas. Gland, Switzerland and Malaga, Spain: IUCN. 32 pages.
JANIK, V. M., SAYIGH, L. S. & WELLS, R. S. 2006. Signature whistle shape conveys identity information to bottlenose dolphins. Proceedings of the National Academy of Sciences. 103:8293-8297
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
KASUYA, T., TOBAYAMA, T. & MATSUI, S. 1984. Review of the Live-capture of small cetaceans in Japan. Report of the International Whaling Comission. 34:597-602
LAHAYE, V., BUSTAMANTE, P., DABIN, W., VAN CANNEYT, O., DHERMIAN, F., CESARINI, C., PIERCE, G. J. & CAURANT, F. 2006. New insights from age determination on toxic element accumulation in striped and bottlenose dolphins from Atlantic and Mediterranean waters. Marine Pollution Bulletin. 52:1219-1230
LLEONART, J. 2005. Mediterranean and Black Sea. In: Review of the state of the world marine fishery resources. FAO Fisheries Technical Paper 457, FAO UN:49-64
LOCKYER, C. H. & MORRIS, R. J. 1990. Some observations on wound healing and persistence of scars in Tursiops truncatus. Report of the International Whaling Comission. Special Issue 12:113-118
McFEE, W. E., SCHWACKE, J. H., STOLEN, M. K., MULLIN, K. D. & SCHWACKE, L. H. 2010. Investigation of growth phases for bottlenose dolphins using a Bayesian modeling approach. Marine Mammal Science. 26(1):67-85
MIYASHITA, T. 1993. Abundance of dolphin stocks in the western North Pacific taken by the Japanese drive fishery. Report of the International Whaling Comission. 43:417-437
NATOLI, A. 2004. Molecular ecology of bottlenose (Tursiops sp.) and common (Delphinus sp.) dolphins. PhD thesis, University of Durham
NATOLI A., BIRKUN, A., AGUILAR, A., LOPEZ, A. & HOELZEL, A. R. 2005. Habitat structure and the dispersal of male and female bottlenose dolphins (Tursiops truncatus). Proceeding of the Royal Society. 272:1217-1226
PERRIN, W. F. & REILLY, S. 1984. Reproductive parameters of dolphins and small whales of the family Delphinidae. Report of the International Whaling Comission. (Special Issue 6):97-133
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
QUICK, N. J. & JANIK, V. M. 2012. Bottlenose dolphins exchange signature whistles when meeting at sea. Proceedings of the Royal Society. 279:2539-2545
REIJNDERS, P. J. H. 1998. Reproductive and Developmental Effects of Endocrine-Disrupting Chemicals on Marine Mammals. in In: T.J. O’Shea, R.R. Reeves & A. Kirk Long (eds.) 1998. Marine mammals and persistent ocean contaminants: proceedings of the Marine Mammal Commission workshop, Keystone, Colorado. Marine Mammmal Commission, 1999, pp.93-100
REEVES, R. R., SMITH, B. D., CRESPO E. & NOTARBARTOLO DI SCIARA. 2003. Dolphins, Whales and Porpoises: 2000-2010 Conservation Action Plan for the World’s Cetaceans. IUCN, Gland, Switzerland. 139 pp.
REEVES, R. R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 64 pp.
SHANE, S. H., WELLS, R. S. & WÜRSIG, B. 1986. Ecology, behaviour and social organization of the bottlenose dolphin: A review. Marine Mammal Science. 2(1):34-63
SHIRIHAI, H. & JARRET, B. 2006. Whales dolphins and seals: A field guide to marine mammals of the world. First edition. A&C Black. London
TRIOSSI, F., WILLIS, T. J. & PACE, D. S. 2012. Occurrence of bottlenose dolphins Turiops truncatus in natural gas fields of the northwestern Adriatic Sea. Marine Ecology. 34:373-379
WADE, R., P. & GERRODETTE, T. 1993. Estimates of cetacean abundance and distribution in the Eastern Tropical Pacific. Report of the International Whaling Comission. 43:477-493
WALKER, J. L., POTTER, C. W. & MACKO, S. A. 1999. The diets of modern and historic bottlenose dolphins populations reflected through stable isotopes. Marine Mammal Science. 15(2):335-350
WEIR, R. C., CANNING, S., HEPWORTH, K., SIM, I. & STOCKIN, K. A. 2008. A long-term opportunistic photo-identification study of bottlenose dolphins (Tursiops truncatus) off Aberdeen, United Kingdom: Conservation Value and Limitations. Aquatic Mammals. 34(4):436-447
WELLS, R. S. & SCOTT, M. D. 1990. Estimating bottlenose dolphinpopulation parameters from individual identification and capture-release techniques. Report of the International Whaling Comission. Special Issue 12:407-415
WELLS, R. S. 2003. Dolphin social complexity: Lessons from long-term study and life history. In “Animal Social Complexity: Intelligence, Culture, and Individualized Societies” (DE WAAL, F., B., M., & TYACK, P., L., eds), pp. 32–56. Harvard University Press, Cambridge.
WÜRSIG, B. & JEFFERSON, T. 1990. Methods of photo-identification for small cetaceans. Report of the International Whaling Comission. Special Issue 12:43-52
http://www.iucnredlist.org/details/22563/0
http://www.iucnredlist.org/details/16369383/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/