CC: Gonzalo Jara / Associació Cetàcea
Se puede confundir con: Delfín mular
Patrón de natación:
![]()
![]()
El calderón gris (Grampus griseus) es un cetáceo que de la familia Delphinidae que recibe este nombre por la morfología globosa que presenta su frente, aunque en este caso no es tan marcado como en el calderón negro de aleta larga (Globicephala melas).
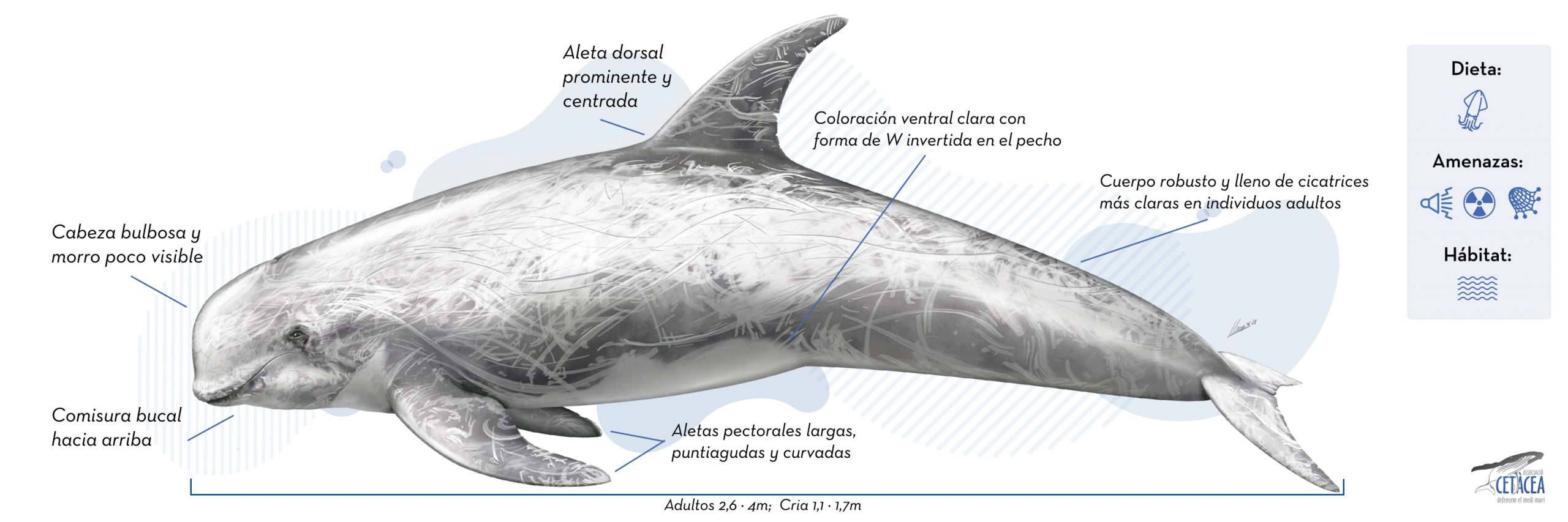
Se trata de un delfín de tamaño medio, con un cuerpo robusto y bastante compacto, que tiene la cabeza con forma globosa y no presenta un hocico diferenciado. La línea de la boca apunta hacia arriba y hacia atrás. Visto lateralmente, el melón tiene forma más bien cuadrada y presenta un pliegue vertical en la parta frontal. La aleta dorsal es grande, alta, puntiaguda, pero de base estrecha, y está colocada en la mitad del cuerpo. Las aletas pectorales son bastante largas, puntiagudas y un poco curvadas. El pedúnculo caudal es más bien estrecho dorsoventralmente y contrasta claramente con la parte anterior del cuerpo, que es más gruesa.
La coloración general de los individuos es gris, pero puede variar hasta completamente blanca en los individuos más grandes, debido a las interacciones producidas por las interacciones con otros individuos de la misma especie o por marcas hechas por sus presas. Esta es la característica principal de la especie, que es seguramente la que presenta un mayor número de heridas de entre todos los cetáceos. Además, tienen una mancha blanca o clara con forma de ancla o de W invertida en la parte ventral anterior y otra mancha clara o blanca alrededor del área urogenital. Los individuos más jóvenes varían entre el color gris claro y el oscuro o marronoso y generalmente no presentan heridas.
Presentan una dentición muy característica que está formada por entre 2 y 7 pares de dientes redondeadas en la punta de la mandíbula inferior. Generalmente no presenta dientes en la mandíbula superior.
Se trata de una especie de medida media entre los delfines. Los adultos pueden llegar a medir un máximo de entre 2,6 y 4 metros y pesar entre 300 y 500 kg, mientras que los neonatos miden entre 1,1 y 1,7. Las hembras podrían ser un poco más pequeñas que los machos, y parece ser que habría cierta variación en el tamaño de los individuos de las distintas regiones.
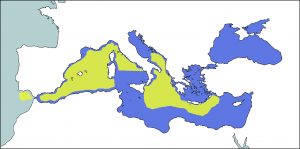
Es una especie que esta distribuida por todos los mares tropicales y templados del mundo, en aguas más calientes de 10° C. Está asociada sobretodo a aguas cercanas a los taludes continentales desde Terranova, Noruega, la península de Kamchatka y el golfo de Alaska en el hemisferio norte, hasta el cabo de Hornos (América) y de Agulhas (África), el sur de Australia y el sur de Nueva Zelanda en el hemisferio Sur (Jefferson et al., 2008; Perrin et al., 2009; Jefferson et al., 2013). Estudios recientes parecen indicar que la especie mostraría una distribución circumglobal, mostrando pero una preferencia por las aguas del talud continental (Jefferson et al., 2013).
En el Mediterráneo aún hay mucha incertidumbre sobre su distribución. Aunque es una especie bastante fácil de estudiar (Jefferson et al., 2013), se ha obtenido poca información sobre ella (Bearzi et al., 2011). Se cree que está distribuida por toda la cuenca, pero no de forma abundante y que su presencia en las diferentes áreas es, de momento, bastante impredecible (Gaspari, 2004; Reeves and Notarbartolo di Sciara, 2006 & Bearzi et al., 2011). En general, su presencia es mayor en el oeste de la cuenca. Las zonas donde es más abundante, puede ser debido a que esfuerzo en la investigación ha sido mayor, son el mar de Alborán y el mar de Liguria, donde se cree que podría haber una población estable. También está presente en el mar Tirreno, el mar Balear y en los mares de Grecia (Notarbartolo di Sciara et al., 1993; Cañadas and Sagarminaga, 1994; Frantzis et al., 2003; Gaspari, 2004; Cañadas et al, 2005; Gannier, 2005; Gomez de Segura et al., 2006 & Bearzi et al., 2011).
La población del Mediterráneo estaría genéticamente diferenciada de la del Atlántico norte y presentaría cierta estructuración interna (Gaspari, 2004 & Gaspari et al., 2007)
El calderón gris es un cetáceo que vive en hábitats entre 400 y 1.000 metros de profundidad, cercanos a la plataforma y al talud continentales, o asociados a archipiélagos alejados de la costa (Perrin et al., 2009 & Bearzi et al., 2011). En el Mediterráneo, diferentes estudios han permitido ver que es una especie que muestra una preferencia por el talud continental, sobretodo aquellas áreas con una pendiente pronunciada (Cañadas et al., 2002 & Azzellino et al., 2008). La profundidad media a la que suele ser observado este cetáceo se sitúa entre los 700 y los 1.280 metros, con un pico alrededor de los 1.000 metros. A pesar de eso, el rango de profundidad en el que puede ser observado va desde los 400 hasta los 1.700 metros (Notarbartolo di Sciara et al., 1993; Cañadas and Sagarminaga, 1994; Cañadas et al., 2002; Frantzis et al., 2003; Gannier, 2005 & Azzelino et al., 2008). Eso si, presenta pequeñas variaciones en función del área estudiada (Bearzi et al., 2011).
El calderón gris se alimenta casi exclusivamente de cefalópodos, sobretodo calamares mesopelágicos, y seguramente lo hace de noche, cuando sus presas suben hacia aguas más superficiales (Perrin et al., 2009; Soldevilla et al., 2010 & Bearzi et al., 2011). De hecho, la reducción del número de dientes respecto a otras especies de delfínidos, es un carácter relacionados con la alimentación a base de cefalópodos. En el Mediterráneo las presas principales pertenecen a las familias Histioteuthidae y Ommastrephidae, siendo las especies más habituales la pota (Todarodes sagittaus), Ancistroteuthis lichtensteinii, Histioteuthis reversa o H. bonnellii (Blanco et al., 2006 & Praca and Grannier, 2008). Un estudio realizado mediante el análisis de 15 calderones varados, vio que su dieta estaba formada por hasta 25 especies de cefalópodos agrupadas en 13 familias diferentes (Blanco et al., 2006). Es necesario mencionar la importancia de los octópodos, que significaban el 49,9% de las presas (Blanco et al., 2006). El mismo estudio sugiere que, a pesar de que muestran una presencia menor, los calamares pelágicos como pueden ser Todarodes sagittatus o Ommastrephes bartramii, serían más importantes en términos de biomasa, gracias a su mayor tamaño (Blanco et al., 2006). En general, la gran mayoría de especies que sirven de alimentación para el calderón gris, habitan aguas con una profundidad de entre 600 y 800 metros, que coincide con el hábitat del cetáceo (Blanco et al., 2006 & Praca and Garnier, 2007).
Hay muy poca información sobre la reproducción y el ciclo vital del calderón gris. Los nacimientos suelen variar en función de la región, situándose los picos entre el verano y el otoño en Japón y entre el otoño y el invierno en California (Jefferson et al., 2008). La gestación se alarga entre 13 y 14 meses y el periodo entre partos suele durar unos 2,4 años. Las hembras alcanzan la madurez sexual entre los 8 y los 10 años, mientras que los machos lo hacen un poco más tarde, entre los 10 y los 12 (Perrin et al., 2009). La edad máxima se estima alrededor de los 35 años.
En general forman grupos pequeños de entre 10 i 100 individuos, siendo la media unos 30 animales, aunque se pueden formar agrupaciones de hasta 4.000 calderones, que se han relacionado con zonas donde se concentra el alimento (Jefferson et al., 2008; Perrin et al., 2009 & Bearzi et al., 2011). En el Mediterráneo, los grupos tienden a ser más bien pequeños, entre 1 y 130 animales, con una media de entre 4 y 37 individuos (Notarbartolo di Sciara et al., 1993; Cañadas and Sagarminaga, 1994; Cañadas et al., 2002; Gannier, 2005; Gomez de Segura et al., 2006 & Azzellino et al., 2008).
Se le ha visto asociado con otras especies de cetáceos entre las que destacan el delfín de flanco blanco del pacífico (Lagenorhynchus obliquidens), el delfín oscuro (L. obscurus), el delfín mular (Tursiops truncatus), el delfín común (Delphinus spp.) diferentes especies del género Stenella e incluso con la ballena gris (Eschrichtius robustus). En el Mediterráneo de le ha visto asociarse con el delfín mular y el delfín listado (Stenella coeruleoalba) (Bearzi, 2011).
Es muy fácil de reconocer en el mar gracias a la presencia de heridas, sobretodo en individuos adultos, y a la aleta dorsal grande y prominente. Se puede confundir con el delfín mular, pero la ausencia de hocico diferenciado, la frente redondeada y la gran cantidad de heridas blancas que presentan los individuos adultos, son características que ayudan en su indentificación (Shirihai and Jarret, 2006).
Generalmente es activo en la superfície, donde los individuos inmaduros pueden realizar saltos, mientras que los individuos de más edad realizan medios saltos. Realiza salidas a espiar con frecuencia, durante las que saca la cabeza y la parte más anterior del cuerpo fuera del agua. A pesar de que lo puede hacer, raramente surfea las olas o sigue a las embarcaciones. Generalmente tiende a ignorarlas y navega lentamente. Cuando cazan, pueden mostrar una disposición en línea unos al lado de otros. El patrón de inmersión empieza con el animal saliendo formando un ángulo de 45° respecto a la línea del agua y casi saca la aleta caudal fuera cuando se vuelve a hundir. Habitualmente las inmersiones duran entre 1 y 2 minutos, aunque pueden alargarse hasta los 30 (Carwardine, 2004 & Shirihai and Jarret, 2006).
Muchos cetáceos pueden ser identificados individualmente gracias a algunas marcas que presentan en varias zonas de su cuerpo. Estas marcas tienen que presentar una cierta estabilidad en el tiempo que permita que los diferentes ejemplares puedan ser reconocidos cada vez que son fotografiados. En el caso del calderón gris, se pueden utilizar varias características físicas para la identificación individual (Würsig and Jefferson, 1990 & Hartman et al., 2008).
Aleta dorsal: La forma de la aleta dorsal y las muescas que presenta su margen posterior se pueden utilizar como mecanismos de foto-identificación en esta especie. Además, las heridas que presentan los individuos en los dos laterales de las aletas, también pueden ser utilizadas como marcas de identificación individual. Por este motivo conveniente realizar fotografias de ambos lados de los animales.
Heridas: Los calderones grises van adquiriendo heridas a lo largo de su vida. La distribución, el tamaño y el número de heridas puede ser útil para identificar individuos concretos. A pesar de eso, hay que tener en cuenta que éstas irán aumentando a lo largo de la vida y que las heridas más antiguas puede quedar tapadas o alteradas por heridas más recientes, pudiendo dificultar el reconocimiento de los individuos en años posteriores.
No hay estimaciones sobre la población mundial del calderón gris, pero si que se ha estudiado la abundancia en algunas regiones determinadas. El océano Pacífico sería el área donde las poblaciones serían mayores, con unos 83.000 ejemplares en Japón (Miyashita, 1993) y unos 175.000 en el Pacífico tropical este (Wade and Gerrodette, 1993). En la costa oeste de Estados Unidos habrían entre 4.000 y 16.000 individuos según la época del año y según los diferentes estudios realizados, mientras que en la costa este habría unos 20.000 (UICN) y en la parte norte del golfo de México unos 2.700 (Jefferson et al., 2008). En el archipiélago de Hawaii, la población se estima en unos 2.372 individuos (Barlow et al., 2006) y en Sri Lanka, varía entre 5.500 y 13.000 animales (Jefferson et al., 2008). A pesar de que no se conoce cual esta la tendencia poblacional, la UICN (Unión Internacional para la Conservación de la Naturaleza) ha catalogado la especie bajo el estatus de preocupación menor. En el Mediterráneo solo se ha estimado la población en aguas de la costa este de la Península Ibérica, que estaría formada por unos 493 individuos (Gomez de Segura et al., 2006). La falta de datos concretos sobre la abundancia de calderones grises en la región, ha llevado a la UICN a catalogarlo bajo el estatus de datos insuficientes. Hay varias amenazas que afectan a la especie en esta región:
El calderón gris está protegido por diferentes conveinos internacionales entre los que se incluyen el apéndice I del Convenio sobre el Comercio Internacional de Especies Amenazadas de Flora y Fauna Silvestres (CITES), por los apéndices I y II de la Convención de Especies Migratorias (CMS) o el Acuerdo sobre la Conservación de los Cetáceos del mar Negro, Mediterráneo y el área Atlántica adyacente (ACCOBAMS). La presencia del santuario de Pelagos en el mar de Liguria ha demostrado ser una herramienta importante para su conservación, y más teniendo en cuneta que es una de las áreas con mayor presencia de esta especie. Además, la reciente declaración de nuevos Espacios de Interés Comunitarios en el mar de Alborán, otra área importante en la distribución de la especie, también puede ser una herramienta importante para su conservación.
AGUILAR, A. 2000. Population biology, conservation threats and status of Mediterranean striped dolphins (Stenella coeruleoalba). Journal of Cetacean Research and Management 2(1):17-26
AZZELLINO, A., GASPARI, S., AIROLDI, S. & NANI, B. 2008. Habitat use and preferences of cetaceans along the continental slope and the adjacent pelagic waters in the Ligurian Sea. Deep-Sea Research. 55:296-323
BARLOW, J. 2006. Cetaceans abundance in Hawaiian waters estimated from a summer/fall survey in 2002. Marine Mammal Science 22(2):446-464
BEARZI, G. 2002. Interactions between cetacean and fisheries in the Mediterranean Sea. In: G. Notarbartolo di Sciara (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 9, 20 p.
BEARZI, G., REEVES, R. R., REMONATO, E., PIERANTONIO, N. & AIROLDI, S. 2011. Risso’s dolphin Grampus griseus in the Mediterranenan Sea. Mammalian Biology. 76:385-400
BLANCO, C., RADUÁN, M. A. & RAGA, J. A. 2006. Diet of Risso’s dolphin (Grampus griseus) in the western Mediterranean Sea. Scientia Marina. 70(3):407-411
CAÑADAS A. & SAGARMINAGA, R. 1994. Estudio de distribución y dinámica de las poblaciones de cetáceos en las aguas del sudeste español. Proyecto Alnitak
CAÑADAS, A., SAGARMINAGA, R. & GARCÍA-TISCAR S. 2002. Cetacean distribution related with depth and slope in the Mediterranean waters of southern Spain. Deep-Sea Research. 49:2053-2073
CAÑADAS, A., SAGARMINAGA, R., DE STEPHANIS, R., URQUIOLA, E. & HAMMOND, P. S. 2005. Habitat preference modelling as aconservation tool: proposal for marine protected areas for cetaceans in southern Spanish waters. Aquatic Conservation: Marine and Freshwater Ecosystems. 15:495-521
CARWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
CORNAX, M. J. & PARDO, E. 2009. Adrift: Swordfish and Driftnets in the Mediterranean Sea. Oceana Europe. Madrid
COX, T. M., RAGEN, T. J., READ, A. J., VOS, E., BAIRD, R. W., BALCOMB, K., BARLOW, J., CALDWELL, J., CRANFORD, T., CRUM, L., D’AMICO, A., D’SPAIN, G., FERNANDEZ, A., FINNERAN, J., GENTRY, R., GERTH, W., GULLAND, F., HILDEBRAND, J., HOUSER, D., HULLAR, T., JEPSON, P. D., KETTEN, D., MACLEOD, C. D., MILLER, P., MOORE, S., MOUNDAIN, D. C., PALKA, D., PONGANIS, P., ROMMEL, S., ROWLES, T., TAYLOR, B., TYACK, P., WARTZOK, R. GISINER, MEAD, J., & BENNER, L. 2006. Understanding the impacts of anthropogenic sound on beaked whales. Journal of Cetacean Research and Management. 7(3):177-187
DI NATALE, A. & NOTARBARTOLO DI SCIARA, G. 1994. A review of the passive fishing nets and trap fisheries in the Mediterranean Sea and of cetacean bycatch. Report of the International Whaling Commission. Special issue 15:189-202
E. J. F. 2007. Illegal Driftnetting in the Mediterranean. Environmental Justice Foundation, London, UK.
FERNÁNDEZ, A., EDWARDS, J. F., RODRÍGUEZ, F., ESPINOSA DE LOS MONTEROS, A., HERRÁEZ, P., CASTRO, P., JABER, J. R., MARTÍN, V. & ARBELO, M. 2005. “Gas and Fat Embolic Syndrome” involving a mass stranding of beaked whales (Family Ziphiidae) exposed to anthropogenic sonar signals. Veterinary Patology. 42:446-457
FOSSI, M. C. & MARSILI, L. 2003. Effects of endocrine disruptors in marine mammals. Pure and Applied Chemistry. 75:2235-2247
FRANTZIS, A., ALEXIADOU, P., PAXIMADIS, G., POLITI., E., GANNIER, A. & CORSINI-FOKA, M. 2003. Current knowledge of the cetacean fauna of the Greek Seas. Journal of Cetacean Research and Management. 5(3):219-232
GANNIER, A. 2005. Summer distribution and relative abundance of delphinids in the Mediterranean sea. Revue d’Ecologie (La Terre et la Vie) 60:223-238
GARRISON, L. P. 2007. Interaction between marine mammals and pelagic longline fishing gear in the U.S. Atlantic Ocean between 1992 and 2004. Fishery Bulletin. 105(3):408-417
GASPARI, S. 2004. Social and population structure of striped and Risso’s dolphins in the Mediterranean Sea. Durham Theses. Durham University
GASPARI, S., AIROLDI, S. & HOEZEL, A. R. 2007. Risso’s dolphin (Grampus griseus) in UK waters are differentiated from a population in the Mediterranean Sea and genetically less diverse. Conservation Genetics. 8:727-732
GÓMEZ DE SEGURA, A., CRESPO, E. A., PEDRAZA, S. N., HAMMOND, P. S. & RAGA, J. A. 2006. Abundance of small cetaceans in waters of the central spanish Mediterranean. Marine Biology 150:149-160
HARTMAN, K. L., VISSER, F. & HENDRIKS, A. J. E. 2008. Social structure of Risso’s dlphins (Grampus griseus) ant the Azores: a stratified community based on highly associated social units. Canadian Journal of Zoology. 86(4):294-306
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
JEFFERSON, T. A., WEIR, C. R., ANDERSON, R. C., BALANCE, L. T., KENNEDY, R. D. & KISZKA, J. J. 2013. Global distribution of Risso’s dolphin Grampus griseus: a review and critical evaluation. Mammal Review. 44:56-68
MACÍAS LÓPEZ, D. GARCÍA BARCELONA, S., BÁEZ, J. C., DE LA SERNA, J. M. & ORTIZ DE URBINA, J. M. 2012. Marine mammal bycatch in Spanish Mediterranean large pelagic longline fihseries, with focus on Risso’s dolphin (Grampus griseus). Aquatic Living Resources. 25:321-331
MIYASHITA, T. 1993. Abundance of dolphin stocks in the western North Pacific taken by the Japanese drive fishery. Report of the International Whaling Comission. 43:417-437
NOTARBARTOLO DI SCIARA, G., VENTURINO, M. C., ZANARDELLI, M., BEARZI, G., BORSANI, F. J. & CAVALLONI, B. 1993. Cetaceans in the central Mediterranean sea: Distribution and sighting frequencies. Bolletino di Zoologia. 60:131-138
NOTARBARTOLO DI SCIARA, G., FRANTZIS, A. & RENDELL, L. 2012. Sperm whales in the Mediterranean: The difficult art of coexisting with humans in a crowded sea. Whalewatcher, Journal of the American Cetacean Society. 41(1)30-38
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
PRACA, E. & GANNIER, A. 2008. Ecological niches of three teuthophageous odontocetes in the northwestern Mediterranean Sea. Ocean Science. 4:49-59
REEVES, R. R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 64 pp.
REIJNDERS, P. J. H. 1998. Reproductive and Developmental Effects of Endocrine-Disrupting Chemicals on Marine Mammals. in In: T.J. O’Shea, R.R. Reeves & A. Kirk Long (eds.) 1998. Marine mammals and persistent ocean contaminants: proceedings of the Marine Mammal Commission workshop, Keystone, Colorado. Marine Mammmal Commission, 1999, pp.93-100
SHIRIHAI, H & JARRET, B. 2006. Whales dolphins and seals: A field guide to the marine mammals of the world. A & C Black, London
SOLDEVILLA, M. S., WIGGINS, S. M. & HILDEBRAND, J. A. 2010. Spatial and temporal patterns of Risso’s dolphin echolocation in the Southern California Bight. Journal of the Acoustical Society of America. 127(1):124-132
WADE, R., P. & GERRODETTE, T. 1993. Estimates of cetacean abundance and distribution in the Eastern Tropical Pacific. Report of the International Whaling Comission. 43:477-493
WÜRSIG, B. & JEFFERSON, T. 1990. Methods of photo-identification for small cetaceans. Report of the International Whaling Comission. Special Issue 12:43-52
http://www.iucnredlist.org/details/9461/0
http://www.iucnredlist.org/details/16378423/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/