CC: Gonzalo Jara / Associació Cetàcea
Es pot confondre amb: Dofí mular
Patró de natació:
![]()
Preocupación Menor (UICN)
![]()
El cap d’olla gris (Grampus griseus) és un cetaci de la família Delphinidae, que rep aquest nom, per la morfologia globosa que presenta el seu front, tot i que en aquest cas, no és tan marcat com en el cap d’olla negre d’aleta llarga (Globicephala melas).
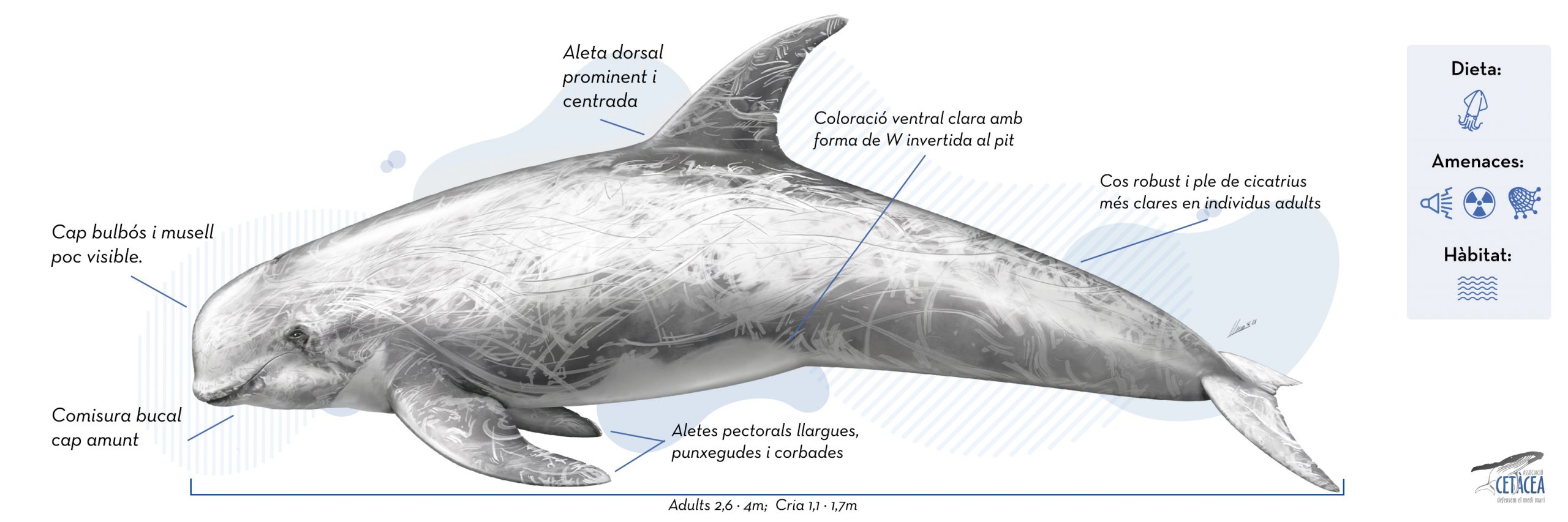
Es tracta d’un dofí de mida mitjana, amb un cos robust i bastant compacte, que té el cap de forma globosa i no presenta un musell diferenciat. La línia de la boca apunta cap amunt i cap enrere. Vist lateralment, el meló té una forma més aviat quadrada i presenta un plec vertical a la part frontal. L’aleta dorsal és gran, alta, punxeguda, però de base estreta, i està col·locada al mig del cos. Les aletes pectorals són força llargues, punxegudes i una mica corbades. El peduncle caudal és més aviat estret dorsoventralment i contrasta clarament amb la part anterior del cos, que és més gruixuda.
La coloració general dels individus adults és grisa, però pot anar variant fins a completament blanca, en els individus més grans, degut a les ferides produïdes per les interaccions amb altres individus de la mateixa espècie, o per marques fetes per les seves preses. Aquesta és la característica principal de l’espècie, que és segurament la que presenta un major nombre de ferides d’entre tots els cetacis. A més a més tenen una taca blanca o clara amb forma d’àncora o de W invertida a la part ventral anterior i una altra taca clara o blanca al voltant de l’àrea urogenital. Els individus més joves varien entre color gris clar fins a gris fosc o marronós i generalment no presenten ferides.
Presenten una dentició molt característica que està formada per entre 2 i 7 parells de dents arrodonides a la punta de la mandíbula inferior. Generalment no presenten dents a la mandíbula superior.
Es tracta d’una espècie de mida mitjana entre els dofins. Els adults poden arribar a mesurar un màxim d’entre 2,6 i 4 metres i pesar entre 300 i 500 kg, mentre que els nounats mesuren entre 1,1 i 1,7. Les femelles podrien ser una mica més petites que els mascles i sembla que hi podria haver certa variació en la mida dels individus de les diferents regions.
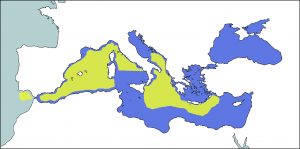
És una espècie que està distribuïda per tots els mars tropicals i temperats del món, en aigües més calentes de 10° C. Està associada sobretot a aigües properes als talussos continentals des de Terranova, Noruega, la península de Kamtxatka i el golf d’Alaska a l’hemisferi nord fins als cap Horn (Amèrica) i el cap Agulhas (Àfrica), el sud d’Asutràlia i al sud de Nova Zelanda a l’hemisferi Sud (Jefferson et al., 2008; Perrin et al., 2009; Jefferson et al., 2013). Estudis recents semblen indicar que l’espècie mostraria una distribució circum-global, mostrant però una preferència per aigües del talús continental (Jefferson et al., 2013).
Al Mediterrani hi ha encara molta incertesa sobre la seva distribució. Tot i que és una espècie força fàcil d’estudiar (Jefferson et al., 2013), s’ha obtingut poca informació sobre ella (Bearzi et al., 2011). Es creu que està distribuïda per tota la conca, però no de forma abundant i la seva presència en les diferents àrees és, de moment, força impredictible (Gaspari, 2004; Reeves and Notarbartolo di Sciara, 2006 & Bearzi et al., 2011). En general, la seva presència és més gran a l’oest de la conca, que no pas a l’est. Les zones on és més abundant, potser degut a que l’esforç en la recerca ha sigut més gran, són el mar d’Alboran i el mar de Ligúria, on es creu que hi podria haver una població estable. També és present al mar Tirrè, al mar balear i als mars de Grècia (Notarbartolo di Sciara et al., 1993; Cañadas and Sagarminaga, 1994; Frantzis et al., 2003; Gaspari, 2004; Cañadas et al, 2005; Gannier, 2005; Gomez de Segura et al., 2006 & Bearzi et al., 2011).
La població del Mediterrani seria genèticament diferent que la de l’Atlàntic nord i presentaria certa estructuració interna (Gaspari, 2004 & Gaspari et al., 2007)
El cap d’olla gris és un cetaci que viu en hàbitats entre 400 i 1.000 metres de profunditat, propers a la plataforma i talús continentals o associats a arxipèlags allunyats de la costa (Perrin et al., 2009 & Bearzi et al., 2011). Al Mediterrani diferents estudis han permès veure que és una espècie que mostra una preferència per el talús continental, sobretot en aquelles àrees amb una pendent més pronunciada (Cañadas et al., 2002 & Azzellino et al., 2008). La profunditat mitjana a la que sol ser observat aquest cetaci se situa entre els 700 i els 1.280 metres, amb un pic al voltant dels 1.000. Tot i això, el rang de profunditat en el que pot ser observat va des dels 400 fins als 1.700 metres (Notarbartolo di Sciara et al., 1993; Cañadas and Sagarminaga, 1994; Cañadas et al., 2002; Frantzis et al., 2003; Gannier, 2005 & Azzelino et al., 2008). Ara bé, presenta petites variacions en funció de l’àrea estudiada (Bearzi et al., 2011).
El cap d’olla gris s’alimenta quasi exclusivament de cefalòpodes, sobretot els calamars mesopelàgics, i segurament ho fa de nit, quan les seves preses pugen cap a aigües més superficials (Perrin et al., 2009; Soldevilla et al., 2010 & Bearzi et al., 2011). De fet, la reducció del nombre de dents respecte a altres espècies de delfínids, és un caràcter relacionat amb l’alimentació a base de cefalòpodes. Al Mediterrani les preses principals pertanyen a les famílies Histioteuthidae i Ommastrephidae, essent les espècies més habituals la canana (Todarodes sagittaus), Ancistroteuthis lichtensteinii, Histioteuthis reversa o H. bonnellii (Blanco et al., 2006 & Praca and Grannier, 2008). Un estudi realitzat mitjançant l’anàlisi de 15 caps d’olla avarats va trobar que la seva dieta estava formada per fins a 25 espècies de cefalòpodes agrupades en 13 famílies diferents (Blanco et al., 2006). Cal destacar la importància dels octòpodes que significaven el 49,9% de totes les preses, en especial Argonauta argo, que representava més del 45% de les preses (Blanco et al., 2006). El mateix estudi suggereix que, tot i que mostren una presència menor, espècies de calamars pelàgics com ara Todarodes sagittatus o Ommastrephes bartramii, serien més importants en termes de biomassa, gràcies a la seva mida més gran (Blanco et al., 2006). En general, la gran majoria d’espècies que serveixen d’alimentació per al cap d’olla gris, habiten aigües amb una profunditat entre 600 i 800 metres, que coincideix amb l’habitat del cetaci (Blanco et al., 2006 & Praca and Garnier, 2007).
Hi ha molt poca informació sobre la reproducció i el cicle vital del cap d’olla gris. Els naixements solen variar en funció de la regió, essent els pics entre l’estiu i la tardor a Japó i entre la tardor i l’hivern a Califòrnia (Jefferson et al., 2008). La gestació s’allarga entre 13 i 14 mesos i el període entre parts sol durar uns 2,4 anys. Les femelles assoleixen la maduresa sexual entre els 8 i els 10 anys, mentre que els mascles ho fan una mica més tard, entre els 10 i els 12 (Perrin et al., 2009). L’edat màxima s’estima al voltant dels 35 anys.
En general formen grups petits, d’entre 10 i 100 individus, essent la mitjana uns 30 animals, però es poden arribar a formar agrupacions de fins a 4.000 caps d’olla, que s’ha relacionat amb zones on s’hi concentra l’aliment (Jefferson et al., 2008; Perrin et al., 2009 & Bearzi et al., 2011). Al Mediterrani els grups tendeixen a ser més aviat petits, entre 1 i 130 animals, amb una mitjana d’entre 4 i 37 individus (Notarbartolo di Sciara et al., 1993; Cañadas and Sagarminaga, 1994; Cañadas et al., 2002; Gannier, 2005; Gomez de Segura et al., 2006 & Azzellino et al., 2008).
Se l’ha vist associat amb altres espècies de cetacis entre les que destaquen el dofí de flancs blancs del pacífic (Lagenorhynchus obliquidens), el dofí fosc (L. obscurus), el dofí mular (Tursiops truncatus), el dofí comú (Delphinus spp.) diferents espècies del gènere Stenella i fins i tot la balena gris (Eschrichtius robustus). Al Mediterrani se l’ha vist associar-se amb el dofí mular i el dofí llistat (Stenella coeruleoalba) (Bearzi, 2011).
Al mar és fàcil de reconèixer gràcies a la presència de ferides, sobretot en individus adults, i a la seva aleta dorsal gran i prominent. Es pot arribar a confondre amb el dofí mular, però l’absència de musell diferenciat, el front amb forma arrodonida i la gran quantitat de ferides blanques que presenten els individus adults, són característiques que ajuden en la seva identificació (Shirihai and Jarret, 2006).
Generalment és actiu a la superfície, on els individus immadurs poden realitzar salts, mentre que els individus de més edat fan mitjos salts. Realitza sortides a espiar amb freqüència, durant les quals treu el cap i la part més anterior del cos fora de l’aigua. Tot i que ho pot fer, rarament surfeja les ones o segueix les embarcacions. Generalment tendeix a ignorar-les i navega lentament. Quan cacen poden mostrar una disposició en línia uns al costat dels altres. El patró d’immersió comença amb l’animal surtin formant un angle de 45° respecte la línia de l’aigua i gairebé treu l’aleta caudal a fora quan es torna a enfonsar. Habitualment les immersions solen durar entre 1 i 2 minuts, tot i que poden allargar-se fins a 30 (Carwardine, 2004 & Shirihai and Jarret, 2006).
Molts cetacis poden ser identificats individualment gràcies a algunes marques que presenten en diverses zones del seu cos. Aquestes marques han de presentar una estabilitat en el temps que permeti que els diferents exemplars puguin ser reconeguts cada vegada que són fotografiats. En el cas del cap d’olla gris es poden utilitzar vàries característiques físiques per a la identificació individual (Würsig and Jefferson, 1990 & Hartman et al., 2008).
Aleta dorsal: La forma de l’aleta dorsal i les osques que presenta al seu marge posterior es poden utilitzar com a mecanismes de foto-identificació en aquesta espècie. A més a més, les ferides que presenten els individus als dos laterals de les aletes, també poden ser utilitzades com a marques d’identificació individual. Per això és convenient realitzar fotografies dels dos costats dels animals.
Ferides: Els caps d’olla grisos van adquirint ferides al llarg de la seva vida. La distribució, la mida i el nombre de ferides pot ser útil per a identificar individus concrets. Tot i això, s’ha de tenir en compte que aquestes aniran augmentant al llarg de la vida, i que ferides més antigues poden quedar tapades o alterades per ferides més recents, podent dificultar el reconeixement dels individus en anys posteriors.
No hi ha estimacions sobre la població mundial del cap d’olla gris, però si que s’ha estudiat l’abundància en algunes regions determinades. L’oceà Pacífic seria l’àrea on les poblacions serien més grans, amb uns 83.300 exemplars al Japó (Miyashita, 1993) i uns 175.000 al Pacífic tropical est (Wade and Gerrodette, 1993). A la costa oest d’Estats Units hi haurien entre 4.000 i 16.000 individus segons la època de l’any i segons els diferents estudis realitzats, mentre que a la costa est n’hi hauria uns 20.000 (UICN) i a la part nord del golf de Mèxic uns 2.700 (Jefferson et al., 2008). A l’arxipèlag de Hawaii, la població s’estima en uns 2.372 individus (Barlow et al., 2006) i a Sri Lanka, varia entre 5.500 i 13.000 animals (Jefferson et al., 2008). Tot i que no es coneix quina és la tendència poblacional, la UICN (Unió Internacional per a la Conservació de la Naturalesa) ha catalogat l’espècie sota l’estatus de preocupació menor. Al Mediterrani només s’ha estimat la població a les aigües de la costa est de la Península Ibèrica, que estaria formada per uns 493 individus (Gomez de Segura et al., 2006). La falta de dades concretes sobre l’abundància del cap d’olla gris a la regió, ha portat a la UICN a catalogar-lo sota l’estatus de dades insuficients. Hi ha vàries amenaces que afecten a l’espècie en aquesta regió:
El cap d’olla gris està protegit per diversos convenis internacionals entre els que s’hi inclouen l’apèndix I del Conveni sobre Comerç Internacional d’Espècies Amenaçades de Flora i Fauna Silvestres (CITES), pels apèndix I i II de la Convenció d’Espècies Migratòries (CMS) o l’Acord sobre la Conservació dels Cetacis del mar Negre, Mediterrani i l’Àrea Atlàntica adjacent (ACCOBAMS). La presència del santuari de Pelagos al mar de Ligúria ha demostrat ser una eina important per a la seva conservació, i més tenint en compte que és una de les àrees amb major presència d’aquesta espècie. A més a més, la recent declaració de nous Espais d’Interès Comunitari al mar d’Alboran, una altra àrea important en la distribució de l’espècie, també pot ser una eina important per a la seva conservació.
AGUILAR, A. 2000. Population biology, conservation threats and status of Mediterranean striped dolphins (Stenella coeruleoalba). Journal of Cetacean Research and Management 2(1):17-26
AZZELLINO, A., GASPARI, S., AIROLDI, S. & NANI, B. 2008. Habitat use and preferences of cetaceans along the continental slope and the adjacent pelagic waters in the Ligurian Sea. Deep-Sea Research. 55:296-323
BARLOW, J. 2006. Cetaceans abundance in Hawaiian waters estimated from a summer/fall survey in 2002. Marine Mammal Science 22(2):446-464
BEARZI, G. 2002. Interactions between cetacean and fisheries in the Mediterranean Sea. In: G. Notarbartolo di Sciara (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 9, 20 p.
BEARZI, G., REEVES, R. R., REMONATO, E., PIERANTONIO, N. & AIROLDI, S. 2011. Risso’s dolphin Grampus griseus in the Mediterranenan Sea. Mammalian Biology. 76:385-400
BLANCO, C., RADUÁN, M. A. & RAGA, J. A. 2006. Diet of Risso’s dolphin (Grampus griseus) in the western Mediterranean Sea. Scientia Marina. 70(3):407-411
CAÑADAS A. & SAGARMINAGA, R. 1994. Estudio de distribución y dinámica de las poblaciones de cetáceos en las aguas del sudeste español. Proyecto Alnitak
CAÑADAS, A., SAGARMINAGA, R. & GARCÍA-TISCAR S. 2002. Cetacean distribution related with depth and slope in the Mediterranean waters of southern Spain. Deep-Sea Research. 49:2053-2073
CAÑADAS, A., SAGARMINAGA, R., DE STEPHANIS, R., URQUIOLA, E. & HAMMOND, P. S. 2005. Habitat preference modelling as aconservation tool: proposal for marine protected areas for cetaceans in southern Spanish waters. Aquatic Conservation: Marine and Freshwater Ecosystems. 15:495-521
CARWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
CORNAX, M. J. & PARDO, E. 2009. Adrift: Swordfish and Driftnets in the Mediterranean Sea. Oceana Europe. Madrid
COX, T. M., RAGEN, T. J., READ, A. J., VOS, E., BAIRD, R. W., BALCOMB, K., BARLOW, J., CALDWELL, J., CRANFORD, T., CRUM, L., D’AMICO, A., D’SPAIN, G., FERNANDEZ, A., FINNERAN, J., GENTRY, R., GERTH, W., GULLAND, F., HILDEBRAND, J., HOUSER, D., HULLAR, T., JEPSON, P. D., KETTEN, D., MACLEOD, C. D., MILLER, P., MOORE, S., MOUNDAIN, D. C., PALKA, D., PONGANIS, P., ROMMEL, S., ROWLES, T., TAYLOR, B., TYACK, P., WARTZOK, R. GISINER, MEAD, J., & BENNER, L. 2006. Understanding the impacts of anthropogenic sound on beaked whales. Journal of Cetacean Research and Management. 7(3):177-187
DI NATALE, A. & NOTARBARTOLO DI SCIARA, G. 1994. A review of the passive fishing nets and trap fisheries in the Mediterranean Sea and of cetacean bycatch. Report of the International Whaling Commission. Special issue 15:189-202
E. J. F. 2007. Illegal Driftnetting in the Mediterranean. Environmental Justice Foundation, London, UK.
FERNÁNDEZ, A., EDWARDS, J. F., RODRÍGUEZ, F., ESPINOSA DE LOS MONTEROS, A., HERRÁEZ, P., CASTRO, P., JABER, J. R., MARTÍN, V. & ARBELO, M. 2005. “Gas and Fat Embolic Syndrome” involving a mass stranding of beaked whales (Family Ziphiidae) exposed to anthropogenic sonar signals. Veterinary Patology. 42:446-457
FOSSI, M. C. & MARSILI, L. 2003. Effects of endocrine disruptors in marine mammals. Pure and Applied Chemistry. 75:2235-2247
FRANTZIS, A., ALEXIADOU, P., PAXIMADIS, G., POLITI., E., GANNIER, A. & CORSINI-FOKA, M. 2003. Current knowledge of the cetacean fauna of the Greek Seas. Journal of Cetacean Research and Management. 5(3):219-232
GANNIER, A. 2005. Summer distribution and relative abundance of delphinids in the Mediterranean sea. Revue d’Ecologie (La Terre et la Vie) 60:223-238
GARRISON, L. P. 2007. Interaction between marine mammals and pelagic longline fishing gear in the U.S. Atlantic Ocean between 1992 and 2004. Fishery Bulletin. 105(3):408-417
GASPARI, S. 2004. Social and population structure of striped and Risso’s dolphins in the Mediterranean Sea. Durham Theses. Durham University
GASPARI, S., AIROLDI, S. & HOEZEL, A. R. 2007. Risso’s dolphin (Grampus griseus) in UK waters are differentiated from a population in the Mediterranean Sea and genetically less diverse. Conservation Genetics. 8:727-732
GÓMEZ DE SEGURA, A., CRESPO, E. A., PEDRAZA, S. N., HAMMOND, P. S. & RAGA, J. A. 2006. Abundance of small cetaceans in waters of the central spanish Mediterranean. Marine Biology 150:149-160
HARTMAN, K. L., VISSER, F. & HENDRIKS, A. J. E. 2008. Social structure of Risso’s dlphins (Grampus griseus) ant the Azores: a stratified community based on highly associated social units. Canadian Journal of Zoology. 86(4):294-306
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
JEFFERSON, T. A., WEIR, C. R., ANDERSON, R. C., BALANCE, L. T., KENNEDY, R. D. & KISZKA, J. J. 2013. Global distribution of Risso’s dolphin Grampus griseus: a review and critical evaluation. Mammal Review. 44:56-68
MACÍAS LÓPEZ, D. GARCÍA BARCELONA, S., BÁEZ, J. C., DE LA SERNA, J. M. & ORTIZ DE URBINA, J. M. 2012. Marine mammal bycatch in Spanish Mediterranean large pelagic longline fihseries, with focus on Risso’s dolphin (Grampus griseus). Aquatic Living Resources. 25:321-331
MIYASHITA, T. 1993. Abundance of dolphin stocks in the western North Pacific taken by the Japanese drive fishery. Report of the International Whaling Comission. 43:417-437
NOTARBARTOLO DI SCIARA, G., VENTURINO, M. C., ZANARDELLI, M., BEARZI, G., BORSANI, F. J. & CAVALLONI, B. 1993. Cetaceans in the central Mediterranean sea: Distribution and sighting frequencies. Bolletino di Zoologia. 60:131-138
NOTARBARTOLO DI SCIARA, G., FRANTZIS, A. & RENDELL, L. 2012. Sperm whales in the Mediterranean: The difficult art of coexisting with humans in a crowded sea. Whalewatcher, Journal of the American Cetacean Society. 41(1)30-38
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
PRACA, E. & GANNIER, A. 2008. Ecological niches of three teuthophageous odontocetes in the northwestern Mediterranean Sea. Ocean Science. 4:49-59
REEVES, R. R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 64 pp.
REIJNDERS, P. J. H. 1998. Reproductive and Developmental Effects of Endocrine-Disrupting Chemicals on Marine Mammals. in In: T.J. O’Shea, R.R. Reeves & A. Kirk Long (eds.) 1998. Marine mammals and persistent ocean contaminants: proceedings of the Marine Mammal Commission workshop, Keystone, Colorado. Marine Mammmal Commission, 1999, pp.93-100
SHIRIHAI, H & JARRET, B. 2006. Whales dolphins and seals: A field guide to the marine mammals of the world. A & C Black, London
SOLDEVILLA, M. S., WIGGINS, S. M. & HILDEBRAND, J. A. 2010. Spatial and temporal patterns of Risso’s dolphin echolocation in the Southern California Bight. Journal of the Acoustical Society of America. 127(1):124-132
WADE, R., P. & GERRODETTE, T. 1993. Estimates of cetacean abundance and distribution in the Eastern Tropical Pacific. Report of the International Whaling Comission. 43:477-493
WÜRSIG, B. & JEFFERSON, T. 1990. Methods of photo-identification for small cetaceans. Report of the International Whaling Comission. Special Issue 12:43-52
http://www.iucnredlist.org/details/9461/0
http://www.iucnredlist.org/details/16378423/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/
AVÍS LEGAL – Copyright © 2021 Tots els drets reservats.