ESPÈCIE: Z. cavirostris
Es pot confondre amb: Zífid de Blainville
Característiques d’identificació individual:
Estat de conservació al Mediterrani: Dades insuficients (UICN)
![]()
Estat de conservació al món: Preocupació menor (UICN)
![]()
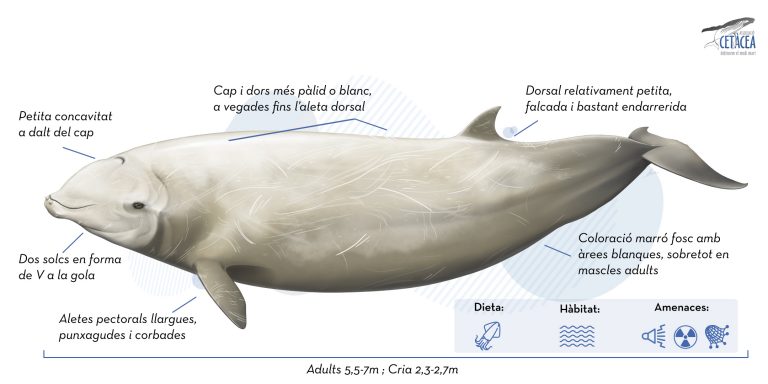
Presenta un cos robust, mitjanament llarg i compacte, característic de la família Ziphiidae. Ni el musell ni el meló estan gaire diferenciats, tot i que en aquest últim cas, pot esdevenir més gran i bulbós en mascles adults. La línia de la boca està bastant corbada. Com altres individus de la família, presenta dos solcs amb forma de “V” a la gola. Una característica bastant distintiva és la presència d’una concavitat a la part superior del cap que es va fent més fàcil de detectar a mesura que els individus creixen. L’aleta dorsal és falcada i petita i està situada bastant enrere, més o menys als 2/3, en l’eix longitudinal del cos. L’aleta caudal és gran i no sempre presenta osca central. Les aletes pectorals són més aviat petites i poden ser amagades en unes depressions del lateral del cos anomenades “flipper pockets”, probablement per afavorir l’hidrodinamisme durant la natació.
És, segurament, un dels cetacis amb una variabilitat més gran pel que fa a la seva coloració, que pot anar des de gris fosc (sobretot en mascles adults) fins a color marró vermellós (majoritàriament en femelles). Presenten dues àrees més clares al voltant del cap i de l’estómac. En adults, el cap i part de l’esquena por ser completament blanca. Els ulls solen estar envoltats d’una pigmentació fosca. Amb l’edat presenten cada vegada més ferides lineals i circulars o ovals, que estarien fetes per petits taurons o llamprees.
Només presenten dues dents còniques, que miren cap endavant, a la part anterior de la mandíbula inferior. Només són visibles en els mascles adults i en els exemplars més grans, fins i tot queden exposades per fora la boca.
No hi ha diferències significatives entre mascles i femelles i la grandària màxima sol estar al voltant dels 7 metres amb un pes d’uns 3.000 kg. Els nounats mesuren entre 2,3 i 2,7 metres i pesen entre 250 i 300 kg.
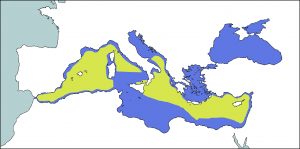
El zífid de Cuvier es l’espècie de la família Ziphiidae amb un distribució més cosmopolita. Es pot trobar en tots els mars i oceans del món, des de les zones càlides i temperades equatorials fins a aigües més fredes properes als pols tant de l’hemisferi nord, com del sud. No és present a les aigües de latituds molt altes. Mostra una clara preferència per aigües allunyades de la costa. També se’ls pot veure en molts mars tancats o semitancats com ara el mar d’Okhotsk, el golf de Califòrnia, el golf de Mèxic, el Carib o el Mediterrani (Jefferson et al., 2008; Taylor et al., 2008 & Perrin et al., 2009).
En aquest últim, no es coneix amb exactitud la seva distribució i la majoria de dades que es tenen provenen d’individus trobats avarats. Es creu que és freqüent tant a la part est com a la part oest de la conca, tot i que s’ha vist que hi ha quatre àrees principals, el mar de Ligúria (sobretot la part est), el mar Tirrè, l’est del mar d’Alboran i el nord oest del mar Egeu, i sembla ser que àrees com el mar Balear o el sud del mar Adriàtic podrien ser favorables per a l’espècie (Reeves and Notarbartolo di Sciara, 2006; Podestà et al., 2006; Holcer et al., 2007; Gannier and Epinat, 2008 & Gannier, 2011).
El zífid de Cuvier està considerat un animal oceànic que ocupa hàbitats marcats per la topografia del fons, però que de forma general presenten escarpaments i canyons submarins. No sol freqüentar àrees d’aigües més superficials, ni tampoc se l’ha vist sovint sobre aigües de fons abissals. Així doncs mostraria una preferència per hàbitats amb profunditats superiors als 500 o 600 metres, generalment superiors a 1.000 metres, i amb pendents fortes, com es poden trobar en els canyons submarins o en el talús continental (Cañadas et al., 2002; Frantzis et al., 2003; Reeves and Notarbartolo di Sciara 2006; Azzellino et al., 2008; Gannier and Espinat, 2008 & Smith, 2010).
Es creu que la presa principal del zífid de Cuvier és el calamar, tot i que s’han fet pocs estudis sobre aquest tema. En les diferents zones del món, s’ha vist que s’alimenten majoritàriament de calamars oceànics, sobretot de les famílies Histioteuthidae, Cranchiidae i/o Gonatidae. Alternativament, el zífid també s’alimentaria de crustacis o de peixos, tot i que serien molt menys importants (Fiscus, 1997; Santos et al., 2001; MacLeod et al., 2003 & Smith, 2010).
Hi força desconeixement sobre la reproducció del zífid de Cuvier, degut a la dificultat que presenta el seu estudi. Se sap que les femelles assoleixen la maduresa sexual quan mesuren al voltant dels 5,8 metres de longitud, mentre que els mascles ho fan als 5,5 metres. Tot i que no hi ha estudis sobre la longevitat d’aquesta espècie, es creu que l’edat màxima dels mascles seia de 36 anys, mentre que la de les femelles seria d’uns 30 anys (Perrin et al., 2009).
La dificultat en el seu estudi ha fet que no hi hagi molta informació sobre la seva ecologia, la seva estructura social o el seu comportament. Tot i això, en els darrers anys s’han realitzat diferents estudis que han permès començar a entendre una mica millor a l’espècie.
En diferents llocs del món s’ha vist que formen grups de pocs individus, entre 1 i 15 de forma general, però podent arribar fins a 25. La mida mitjana del grup oscil·la entre els 2,3 i els 3,8 en funció de la zona o fins i tot en funció de l’època de l’any (Carwardine, 2004; Baird et al., 2006; MacLeod and D’Amico, 2006; McSweeney et al., 2007 & Falcone et al., 2009). A vegades es poden albirar individus solitaris que solen ser mascles vells.
El zífid de Cuvier és, probablement, una de les espècies de mamífers marins capaç de realitzar les immersions d’alimentació més llargues i profundes, arribant a rècords de casi 1.900 metres de profunditat (Tyack et al., 2006). Sembla ser que l’espècie faria tres tipus d’immersions diferents (Baird et al., 2006):
El cicle d’alimentació duraria al voltant d’unes dues hores i estaria format per una immersió profunda (de la segona categoria) i un interval entre immersions profundes. Durant aquest interval es produirien immersions de la primera i tercera categories. Gràcies a les gravacions sonores, s’ha vist que durant les immersions profundes, el zífid de Cuvier mostra una gran activitat d’ecolocalització que comença al voltant dels 400 – 500 metres i s’intensifica entre els 500 i els 1.000 metres, a les zones mesopelàgica i batipelàgica, on es creu que es concentraria l’alimentació de l’espècie (Tyack et al., 2006).
En general tendeix a evitar les embarcacions i rarament salta fora de l’aigua, fets que el fan més difícil de reconèixer. Al mar es pot confondre amb altres espècies de la família Ziphiidae com ara el zífid de Blainville (Mesoplodon densirostris) o el zífid de Gervais (Mesoplodon europaeus), però aquestes altres dues espècies no són tant comuns al Mediterrani i hi ha certes característiques que permeten diferenciar el zífid de Cuvier (Shirihai and Jarret, 2006 & IUCN 2012):
Tot i la dificultat en l’estudi del zífid de Cuvier, degut a la seva naturalesa críptica, s’han vist diferents característiques que permeten la diferenciació de cada un dels individus. En alguns casos la taxa de realbirament arriba al 40%. Com a la resta de cetacis, s’han hagut de buscar marques permanents, que es mantinguin estables al llarg del temps, i que permetin reconèixer-los cada vegada que se’ls veu. Entre aquestes característiques hi figuren (McSweeney et al., 2007)
Aleta dorsal: S’utilitza tant la forma de l’aleta dorsal com la presència o absència de osques al marge posterior de l’aleta.
Patrons de coloració: La coloració general del zífid de Cuvier és molt variable entre els individus i les classes d’edat. Els mascles adults tendeixen a mostrar grans àrees blanques a la part dorsal del cos, per exemple. Aquestes diferències poden ser útils a l’hora de distingir individus concrets.
Ferides: Molt individus de zífid de Cuvier presenten una gran quantitat de ferides corporals, que es mantenen més o menys estables en el temps. Aquelles que es troben a prop de l’aleta dorsal o a les zones més dorsals del cos poden servir per a poder reconèixer individualment els diferents animals.
Tot i la seva dificultat per estudiar-lo, la població mundial del zífid de Cuvier s’estima en més de 100.000 individus (Barlow, 2006a & Barlow et al., 2006b). L’àrea amb una abundància més gran seria el Pacífic nord est amb uns 90.725 individus, seguit per el Pacífic tropical est, amb uns 20.000 i les aigües que rodegen Hawai’i amb 15.242 animals. Altres àrees com la costa oest americana o l’oceà atlàntic presenten uns nombres més baixos. Perquè són amb tota probabilitat el zífid més abundant i el que presenta un rang de distribució més gran, la Unió Internacional per a la Conservació de la Naturalesa, l’ha classificat sota l’estatus de preocupació menor a escala mundial. Al Mediterrani no hi ha gaire informació sobre l’abundància de l’espècie. De fet només hi ha dos estudis que hagin estimat la seva abundància, a la zona de Gènova i la zona nord del mar d’Alboran. Hi ha alguns estudis que s’estan duent a terme que es creu que podran aportar informació valuosa. Precisament per aquesta falta d’informació en tot allò referent a la seva distribució, abundància i estructura poblacional, la UICN ha catalogat el zífid de Cuvier del Mediterrani sota l’estatus de dades insuficients. Les principals amenaces que afecten a l’espècie són:
Un altre efecte que pot causar l’exposició al so és l’alteració de l’estructura poblacional o de la distribució d’una població de zífids en concret. Després de l’avarament massiu de les Bahames, un grup de científics que duien 9 anys estudiant la població de la zona, van ser incapaços de tornar a albirar cap dels individus que havien identificat abans de l’avarament. No queda clar però si aquest fet es deu a que tots els individus van morir o a que van abandonar la zona (Balcomb and Claridge, 2001).
Segurament la naturalesa més aviat oceànica de l’espècie l’ha fet menys vulnerable a l’activitat humana que es produeix sobretot a les costes, que generalment és la més invasiva per als cetacis (pesqueries, turisme, etc.). Al mar Mediterrani la presència del santuari de Pelagos al mar de Ligúria i la recent designació de l’àrea protegida del Mar d’Alboran, dues àrees importants en la distribució de l’espècie, poden afavorir-ne la seva conservació.
El zífid de Cuvier està protegit per diferents convenis internacionals com ara l’apèndix II del Conveni sobre el Comerç Internacional d’Espècies Amenaçades de Flora i Fauna Silvestres (CITES) o l’Acord sobre la Conservació dels Cetacis del mar Negre, Mediterrani i l’Àrea Atlàntica adjacent (ACCOBAMS). Precisament el comitè científic d’aquest últim organisme recomana anar molt amb compte o evitar completament la producció de sons submarins en aquells hàbitats freqüentats per l’espècie o en aquelles zones on se solen concentrar els cetacis.
AZZELLINO, A., GASPARI, S., AIROLDI, S. & NANI, B. 2008. Habitat use and preferences of cetaceans along the continental slope and the adjacent pelagic waters in the Ligurian Sea. Deep-Sea Research. 55:296-323
BAIRD, R. W.; WEBSTER, D. L., MCSWEENEY, D. J., LIGON, A. D., SCHORR, G. S. & BARLOW, J. 2006. Diving behaviour of Cuvier’s beaked (Ziphius cavirostris) and Blainville’s (Mesoplodon densirostris) beaked whales in Hawai’i. Canadian Journal of Zoology. 84:1120-1128
BALCOMB, K. C. III & CLARIDGE, D.E. 2001. A mass stranding of cetaceans caused by naval sonar in the Bahamas. Bahamas Journal of Science. 8(2):2-12
BARLOW, J. 2006a. Cetaceans abundance in Hawaiian waters estimated from a summer/fall survey in 2002. Marine Mammal Science 22(2):446-464
BARLOW, J., FERGUSON, M. C., PERRIN, W. F., BALLANCE, L., GERRODETTE, T., JOYCE, G., MACLEOD, C. D., MULLIN, K., PALKA, D. L. & WARING, G. 2006b. Abundance and densities of beaked and bottlenose whales (family Ziphiidae). Journal of Cetacean Research and Management. 7(3):263-270
CAÑADAS, A., SAGARMINAGA, R. & GARCÍA-TISCAR S. 2002. Cetacean distribution related with depth and slope in the Mediterranean waters of southern Spain. Deep-Sea Research. 49:2053-2073
CARWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
COX, T. M., RAGEN, T. J., READ, A. J., VOS, E., BAIRD, R. W., BALCOMB, K., BARLOW, J., CALDWELL, J., CRANFORD, T., CRUM, L., D’AMICO, A., D’SPAIN, G., FERNANDEZ, A., FINNERAN, J., GENTRY, R., GERTH, W., GULLAND, F., HILDEBRAND, J., HOUSER, D., HULLAR, T., JEPSON, P. D., KETTEN, D., MACLEOD, C. D., MILLER, P., MOORE, S., MOUNDAIN, D. C., PALKA, D., PONGANIS, P., ROMMEL, S., ROWLES, T., TAYLOR, B., TYACK, P., WARTZOK, R. GISINER, MEAD, J., & BENNER, L. 2006. Understanding the impacts of anthropogenic sound on beaked whales. Journal of Cetacean Research and Management. 7(3):177-187
DERUTIER, S. L., SOUTHALL, B. L., CALAMBOKIDIS, J., ZIMMER, W. M. X., SADYKOVA, D., FALCONE, E. A., FRIEDLAENDER, A. S., JOSEPH, J. E., MORETTI, D., SCHORR, G. S., THOMAS, L. & TYACK, P. L. 2013. First direct measurements of behavioural responses by Cuvier’s beaked whales to mid-frequency active sonar. Biology Letters. 9:1-5
FALCONE, E. A., SCHORR, G. S., DOUGLAS, A. B., CALAMBOKIDIS, J., HENDERSON, E., MCKENNA, M. F., HILDEBRAND, J. & MORETI, D. 2009. Sighting characteristics and photo-identification of Cuvier’s beaked whales (Ziphius cavirostris) near San Clemente Island, California: a key area for beaked whales and the military? Marine Biology. 156:2631-2640
FERNÁNDEZ, A. 2004. Pathological findings in stranded beaked whales during the naval military manoeuvres near the Canary Islands. In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
FERNÁNDEZ, A., EDWARDS, J. F., RODRÍGUEZ, F., ESPINOSA DE LOS MONTEROS, A., HERRÁEZ, P., CASTRO, P., JABER, J. R., MARTÍN, V. & ARBELO, M. 2005. “Gas and Fat Embolic Syndrome” involving a mass stranding of beaked whales (Family Ziphiidae) exposed to anthropogenic sonar signals. Veterinary Patology. 42:446-457
FISCUS, C. H. 1997. Cephalod beaks in a cuvier’s beaked whale (Ziphius cavirostris) from Amchitka Island, Alaska. Marine Mammal Science. 13(3):481-486
FRANTZIS, A. 1998. Does acoustic testing strand whales? Nature. 392:29-30
FRANTZIS, A., ALEXIADOU, P., PAXIMADIS, G., POLITI., E., GANNIER, A. & CORSINI-FOKA, M. 2003. Current knowledge of the cetacean fauna of the Greek Seas. Journal of Cetacean Research and Management. 5(3):219-232
FRANTZIS, A. 2004a. The first mass stranding that was associated with the use of active sonar (Kyparissiakos Gulf, Greece, 1996). In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
FREITAS, L. 2004. The stranding of three Cuvier’s beaked whales Ziphius cavirostris in Madeira Archipelago – May 2000. In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
GANNIER, A. & ESPINAT, J. 2008. Cuvier’s beaked whale distribution in the Mediterranean Sea: results from small boat surveys 1996 – 2007. Journal of the Marine Biological Association of the United Kingdom. 88(6):1245-1251
GANNIER, A. 2011. Using existing data on focused surveys to highlight Cuvier’s beaked whales favourable areas: A case study in the central Tyrrenian Sea. Marine Pollution Bulletin. 63:10-17
HOLCER,D., NOTARBARTOLO DI SCIARA, G., FORTUNA, C. M., LAZAR, B. & ONOFRI, V. 2007. Occurence of Cuvier’s beaked whales in the southern Adriatic Sea: evidence of an important Mediterranean habitat. Journal of the Marine Biological Association of the United Kingdom. 87:359-362
IUCN 2012. Marine Mammals and Sea Turtles of the Mediterranean and Black Seas. Gland, Switzerland and Malaga, Spain: IUCN. 32 pages.
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
MACLEOD, C. D., SANTOS M. B. & PIERCE G. J. 2003. Review of data on diets of beaked whales: evidence of niche separation and geographic segregation. Journal of the Marine Biological Association of the United Kingdom. 83:651-665
MACLEOD, C. D. & D’AMICO, A. 2006. A review of beaked whale behaviour and ecology in relation to assessing and mitigating impacts of anthropogenic noise. Journal of Cetacean Research and Management. 7(3):211-221
MARTÍN, V., SERVIDIO, A. & GARCÍA, S. 2004. Mass stranding of beaked whales in the Canary Islands. In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
MCSWEENEY, D. J., BAIRD, R. W. & MAHAFFY, S. D. 2007. Site fidelity, associations and movements of Cuvier’s (Ziphius cavirostris) and Blainville’s (Mesoplodon densirostris) beaked whales off the island of Hawai’i. Marine Mammal Science. 23(3):666-687
NOTARBARTOLO DI SCIARA, G. 2002. Cetacean species occurring in the Mediterranean and Black Seas. In: G. NOTARBARTOLO DI SCIARA (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 3, 17 p.
NOTARBARTOLO DI SCIARA, G. & BIRKUN A JR. 2010. Conserving whales and dolphins in the Mediterranean and Black seas. An ACCOBAMS status report. ACCOBAMS, Monaco. 212 p
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
PODESTÀ, M., D’AMICO, A., PAVAN, G., DROUGAS, A., KOMMENOU, A. & PORTUNATO, N. 2006. A review of Cuvier’s beaked whale strandings in the Mediterranean Sea. Journal of Cetacean Research and Management. 7(3):251-261
REEVES, R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 137 pp.
SANTOS, M. B., PIERCE, G. J., HERMAN, J., LÓPEZ, A., GUERRA, A., MENTE, E. & CLARKE, M. R. 2001. Feeding ecology of Cuvier’s beaked whale (Ziphius cavirostris): a review with the information on the diet of this species. Journal of the Marine Biological Association of the United Kingdom. 81:687-694
SHIRIHAI, H & JARRET, B. 2006. Whales dolphins and seals: A field guide to the marine mammals of the world. A & C Black, London
SMITH, J. 2010. The ecology of Cuvier’s beaked whale, Ziphius cavirostris (Cetacea: Ziphiidae), in the Bay of Biscay. University of Southampton, UK, Graduate School of the National Oceanography Centre, PhD Thesis, 214 pp.
TAYLOR, B.L., BAIRD, R., BARLOW, J., DAWSON, S.M., FORD, J., MEAD, J.G., NOTARBARTOLO DI SCIARA, G., WADE, P. & PITMAN, R.L. 2008. Ziphius cavirostris. In: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.2.
TYACK, P. L., JOHNSON, M., AGUILAR SOTO, N., STURLESE, A. & MADSEN, P. T. 2006. Extrem diving of beaked whales. The Journal of Experimental Biology. 209:4238-4253
http://www.iucnredlist.org/details/16381144/0
http://www.iucnredlist.org/details/23211/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/
AVÍS LEGAL – Copyright © 2021 Tots els drets reservats.