
CC: Gonzalo Jara / Associació Cetàcea
![]()
![]()
La característica principal, que permite distinguir el género, es la presencia de un frente bulboso, que puede llegar a sobresalir más allá de la boca y que adquiere una forma cuadrangular visa des de arriba. El hocico, si hay, apenas se diferencia de la cabeza. La aleta dorsal tiene una base longitudinal muy ancha, es muy curvada, es grande, sobre todo en los individuos adultos, ya que se alarga longitudinalmente a medida que el individuo se va haciendo más grande. Está situada por delante de la mitad del cuerpo, más o menos en la línea donde se acaba el primer tercio del cuerpo. Las aletas pectorales son muy largas, hecho que las diferencia del calderón de aleta corta (Globicephala macrorhynchus), y presentan una especie de codos en la parte anterior. El pedúnculo caudal es bastante largo y grueso dorsiventralmente.
Su patrón de coloración es el característico del género. El color predominante es el negro (a veces marrón oscuro), presente en todo el individuo, excepto en 3 zonas concretas:
Las crías son más claras que los individuos adultos.
Los calderones tienen menos dientes que la resta de especies de la familia Delphinidae, hecho que seguramente guarda relación con su dieta. En total presentan entre 8 y 13 dientes puntiagudos y afilados en cada mandíbula.
Junto con el cachalote (Physeter macrocephalus) y la orca (Orcinus orca), los calderones son los odontocetos con un dimorfismo sexual más marcado, siendo los machos bastante más grandes que les hembras. Su tamaño medio oscila entre los 3,6 y los 7,5 metros en los machos, que pueden llegar a pesar hasta 3 toneladas; los 3,8 y 5,7 metros en las hembras, que alcanzan los 2 – 2,5 toneladas de peso. Las crías miden entre 1,7 y 2 metros y pesan alrededor de 75 kilogramos.
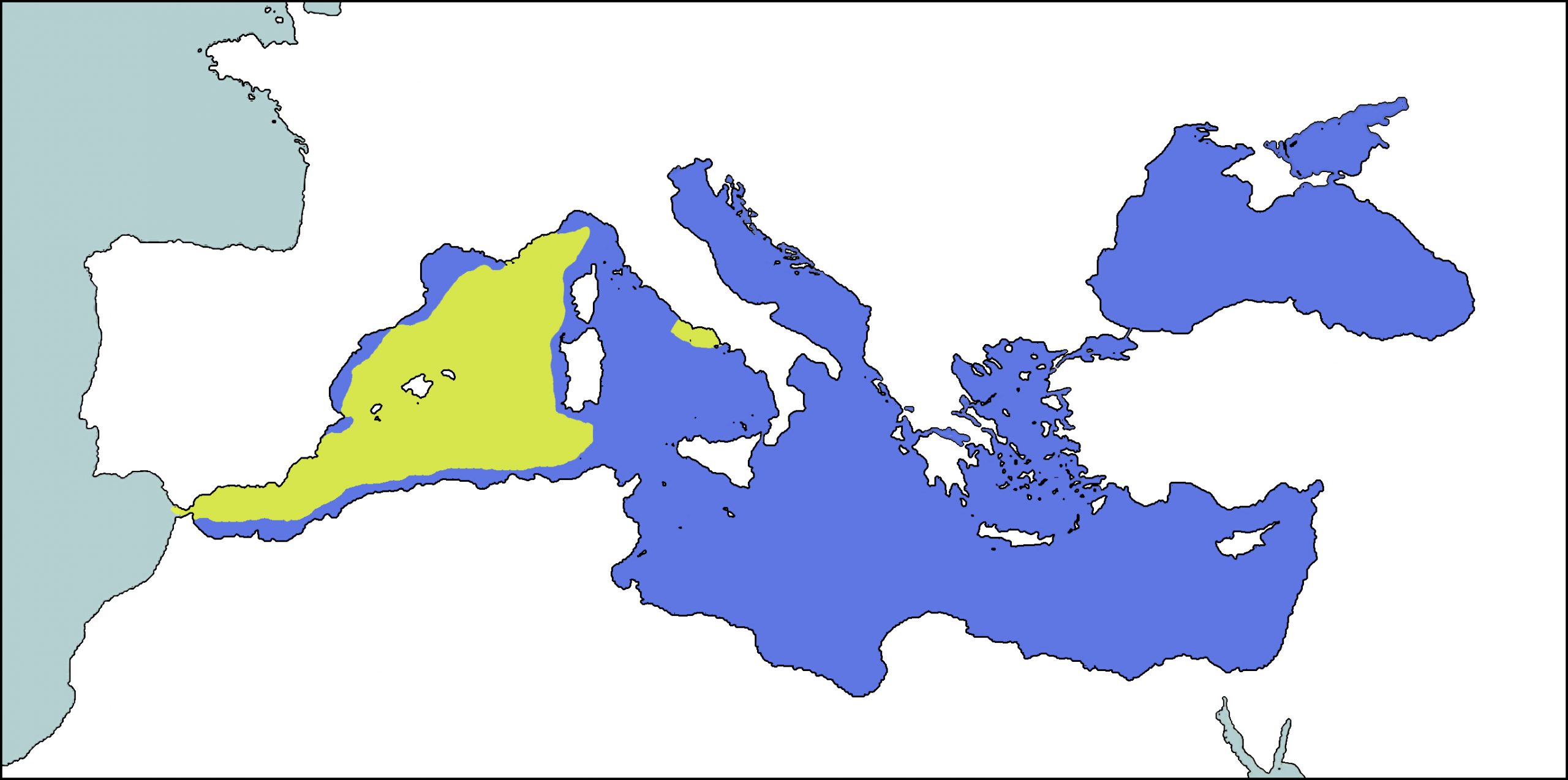
El calderón de aleta larga es una especie que presenta una distribución anti tropical, es decir, se distribuye en aguas templadas y subpolares del Atlántico Norte y de los océanos del hemisferio sur. Antes también se podía encontrarse en el Pacífico Norte, pero ahora se cree que está ausente. Se encuentra sobre todo en aquellas áreas más distantes de la costa, aunque también puede encontrarse en aguas costeras (Jefferson et al., 2008 & Perrin et al., 2009). Las poblaciones de los dos hemisferios están aisladas. Esto contrasta con la distribución de su congénere, el calderón de aleta corta (Globicephala macrorhynchus), que sólo está presente en las aguas tropicales y subtropicales (Perrin et al., 2009). Se estima que la población mundial estaría formada por aproximadamente 1 millón de individuos (Jefferson et al., 2008 & Perrin et al., 2009).

En el Mediterráneo se considera una especie residente, aunque el tamaño, estructura, distribución y dinámica de la población en este mar sigue siendo muy incierto (Cañadas y Sagarminaga, 2000). A pesar de ello, se ha visto que es más abundante en la parte occidental de la cuenca, especialmente en el mar de Alborán y el estrecho de Gibraltar y en menor medida en el extremo noroeste (Mangion y Gannier, 2002 & Gannier, 2005). Parece que la especie tiene una población estable de entre individuos 267 y 273 en el Estrecho de Gibraltar, que en verano serían unos 213 individuos (Verborgh, 2005 y Verborgh et al., 2009). También es muy abundante en el mar de Alborán, donde agruparían hasta varios cientos o pocos miles de individuos (Cañadas y Sagarminaga, 1994; Cañadas y Sagarminaga, 2000; Cañadas et al., 2002 & Cañadas et al., 2005). La proximidad de estas dos áreas sugiere a los autores que los individuos en el Estrecho de Gibraltar y los observados en el mar de Alborán podría pertenecer a la misma población (Verborgh, 2005). En la parte central del Mediterráneo existen muy pocos registros de avistamientos confirmados (Notarbartolo di Sciara, 2002; Notarbartolo di Sciara y Birkun, 2010 & Mussi et al., 2000), mientras que están casi ausentes en la parte oriental de la cuenca.
A pesar del hecho de que la estructura de la población es desconocida, se cree que los individuos que se encuentran en el mar Mediterráneo correspondería a una sola población (Reeves y Notarbartolo di Sciara, 2006). No se tiene ninguna evidencia que existe flujo genético entre individuos del mar Mediterráneo y el océano Atlántico a través del estrecho de Gibraltar. Por otro lado, los estudios realizados en esa zona y en otras partes del Mediterráneo, tienden a indicar que las poblaciones de este mar serían residentes, mostrando una gran lealtad en sus zonas de residencia (Mussi et al., 2000; Verborgh, 2005; De Stephanis, 2008; De Stephanis et al., 2008 & Verborgh et al., 2009).
No se sabe su población total en el Mediterráneo, aunque algunos datos no publicados indican que la población del mar de Alborán se ubicaría entre 1.500 y 1.900 individuos, siendo el más grande en el Mediterráneo.
En varios lugares se ha visto que el calderón de aleta larga vive en hábitats cerca del talud continental, con el fondo marino con pendiente o con un relieve topográfico importante (Perrin et al., 2009). El Mediterráneo ha sido estudiado principalmente en el mar de Alborán y el estrecho de Gibraltar. Todos los estudios realizados en diferentes áreas coincidirían con estudios realizaron en el Mediterráneo. En este sentido, las especies generalmente habitan en aguas con una profundidad de entre 380 y 1.550 metros, con laderas intermedias, mostrando una preferencia por aguas más profundas de 600 metros y llegar a las profundidades del agua que requieren superiores a 2.000 metros (Notarbartolo di Sciara et al., 1993; Baird et al., 2002; Cañadas et al., 2002; Gannier, 2005 & De Stephanis 2008b).
Aunque se nota una cierta variabilidad geográfica y estacional (Santos et al., 2014), se puede decir que el calderón de aleta larga se alimenta principalmente de calamares oceánicos o neríticos. Muestra una especial predilección por las especies Todarodes sagitattus y Loligo pelaei, seleccionándolos por delante de otras especies, durante la temporada en la que están presentes (Palasport and Mouritsen, 1993 & Gannon et al., 1997). En menor medida también se alimenta de calamares perteneciente a la familia Ommastrephidae, las especies del género Gonatus o a las especies Histioteuthis reversa o Chiroteuthis veranyi. Aparte de calamar, también se puede alimentar secundariamente de peces como la caballa (Scomber scombrus), el arenque (Clupea harengus), la maira (Micromesistius poutassou) o la especie Argentina silus, que pueden llegar a ser abundante en la dieta, cuando no hay no hay disponibilidad de calamares (Palasport and Mouritsen, 1993 & Gannon et al., 1997). Las poblaciones del mar de Alborán también podrían nutrirse inicialmente de diferentes especies de calamar, especialmente de Todarodes sagitattus (Cañadas and Sgarminaga, 2000). Aunque las presas de alimento vivo se encuentran bastante profundas, entre 100 y 1.000 metros, parece ser que su migración vertical diaria, le permitiría al calderón de aleta larga su alimentación con menos profundidad, generalmente entre 100 y 500 metros (Desportes and Mouritsen, 1993 & De Stephanis et al., 2008c).
Parece ser que la composición de la dieta puede variar dependiendo del tamaño, edad o estado de cada individuo. Por lo tanto, los animales más pequeños se podrían alimentar de pequeñas presas, mientras que hembras y machos más grandes, presentan una proporción de peces más grandes a su dieta (Palasport y Mouritsen, 1993).
El calderón de aleta larga presenta características compartidas con muchas especies de cetáceos en su ciclo de vital, como una larga esperanza de vida, madurez sexual tardía, maduración diferenciada entre machos y hembras y el hecho de que dar a luz a una sola cría por parto.
En este caso, los machos pueden vivir entre 35 y 45 años de edad, aunque se ha encontrado algún individuo que supera por poco esta edad, mientras que las hembras llegarían hasta los 60 años de edad (Bloch et al., 1993; Jefferson et al., 2008 & Perrin et al., 2009). El período de gestación dura generalmente entre 15 y 16 meses y el intervalo entre partos se alarga alrededor de los tres años. Las crías miden entre 1,7 y 1,8 metros y muestran una fase de rápido crecimiento, seguida de una disminución del crecimiento durante las etapas juveniles (Bloch et al., 1993; Perrin and Reilly, 1984 & Perrin et al., 2009). El destete se empieza a producir sobre los 6 meses, aunque hay individuos que pueden empezar antes, y la lactancia materna puede extenderse hasta los 3 años (Desportes and Mouritsen, 1993; Perrin and Reilly, 1984 & Perrin et al., 2009). La presencia de leche en los estómagos de individuos hasta los 7 años en el caso de los machos y 12 en el de las hembras, sugiere que podrían presentar un periodo de lactancia más prolongada, aunque se debería a razones sociales más que nutricionales (Tyack 1986; Palasport y Mouritsen, 1993 & Perrin et al., 2009). Los individuos alcanzan la madurez sexual a los 12 años en el caso de los machos y 8 en el de las hembras. En general, el apareamiento suele tener lugar entre primavera y verano, aunque en el mar de Alborán se ha observado entre julio y septiembre (Cañadas and Sagarminaga, 2000 & Jefferson et al., 2008).
La estructura social del calderón de aleta larga estaría basada en pequeños grupos lineales estables inicio con filo patria natal de grupo para ambos sexos y que incluyen entre 2 y 4 generaciones de machos y hembras (Ottensmeyer and Whitehead, 2003; De Stephanis, 2008 & De Stephanis et al., 2008a). La estabilidad de estas “unidades sociales básicas” o pods, varía en función de la zona estudiada, siendo bastante efímeras en las aguas de Nueva Escocia y más estables en áreas tales como las Islas Feroe y el estrecho de Gibraltar y el Mediterráneo. Los diferentes pods se juntarían entre ellos para formar grupos más grandes llamados clanes, los cuales pueden estar compuestos entre 20 y 90 individuos, aunque se ha visto que puede estar formados por 80 y 100 individuos en la zona de Nova Scotia y cerca de 150 en el estrecho de Gibraltar (Amos et al., 1990; Ottensmeyer and Whitehead, 2003; De Stephanis, 2008 & De Stephanis et al., 2008a). En otras áreas del Mediterráneo, como el mar de Alborán, las cifras son bastante similares, con el tamaño típico de los grupos entre 7 y 20 individuos y pudiendo alcanzar un máximo de 300 – 350 animales (Cañadas and Sagarminaga, 1994 & Cañadas and Sagarminaga, 2000).
Aunque los pods son grupos matrilineales con fuertes lazos entre madres y sus crías, la reproducción no se produce entre individuos del mismo pod. En el mar de Alborán se ha visto que los machos de un pod muestran altos niveles de asociación con las hembras de otra pod (Cañadas and Sagarminaga, 2000). Diversos autores sugieren la posibilidad de que los machos no se reproduzcan en el mismo pod, sino que lo hacen con individuos de pods diferentes. En el caso de los calderones de aleta larga del estrecho de Gibraltar, se cree que formarían un solo clan, que se reproduciría con individuos de otro clan, posiblemente del mar de Alborán (De Stephanis, 2008 & De Stephanis et al., 2008a).
Es bastante común encontrarlos inmóviles en la superficie, permitiendo que las embarcaciones se acercan a poca distancia. A veces se les puede ver alimentándose o viajando en una formación lineal, con individuos situados uno junto al otro. Pueden saltar junto a la proa de la embarcación, especialmente en el caso de individuos más jóvenes. Un comportamiento típico es el “spyhop”, en el cual el animal saca la cabeza fuera del agua para espiar (Carwardine, 2004 & Shirihai y Jarret, 2006). Normalmente realiza varias inmersiones cortas antes de desaparecer en una inmersión más larga de unos minutos. Cuando se alimenta las inmersiones pueden durar hasta 10 minutos. Se ha visto que las inmersiones durante el día tienden a ser menos profunda (entre 1 y 16 metros), mientras que en la noche serían más profundas y estarían vinculadas, probablemente, con la alimentación (Perrin et al., 2009 & Baird et al., 2002).
En el agua es casi imposible distinguirlo de su congénere, el calderón de aleta corta (Globicephala macrorhynchus), pero sus zonas de distribución se superponen solo en ciertas áreas. Otras especies similares pueden ser la orca (Orcinus orca) o la falsa orca (Pseudorca crassidens), aunque se pueden diferenciar fácilmente por la forma tan característica de la aleta dorsal. Las características que pueden ayudar en su identificación en mar son la cabeza bulbosa, la coloración negra prácticamente en su totalidad, la forma de la aleta dorsal y su posición en el eje longitudinal del cuerpo. Además, el patrón de la inmersión es muy característico, saliendo el primer melón y exhalando el aire. Posteriormente el cuerpo se arquea a más a medida que avanza el animal, hasta que deja completamente a la vista el pedúnculo caudal. Prácticamente nunca sale la aleta caudal fuera del agua antes de iniciar la inmersión (Jefferson et al., 2008 & Shirihai and Jarret, 2006).
Como en muchas otras especies de cetáceos, la cabeza del calderón de aleta larga presenta características específicas que permiten el reconocimiento individual de los animales que forman un grupo. Estas marcas se utilizarán en estudios de investigación que utilizan la foto-identificación como mecanismo principal para distinguir entre los individuos. Es importante que estas marcas sean estables en el tiempo, es decir, que no desaparezcan con la edad. En este sentido se han encontrado tres tipos de marcas que cumplen estos criterios para esta especie (Auger-Méthé and Whitehead, 2007):
Muescas en la aleta dorsal: Como en la mayoría de especies de la familia Delphinidae, los calderones de aleta larga pueden ser reconocidos gracias a la forma de su aleta dorsal y también en la morfología, número y posición de las marcas en su margen posterior. Ésta es la característica principal utilizada por los diferentes grupos de investigación en el mundo. Aun así, el porcentaje de individuos en una población que puede ser identificado en la misma población usando este tipo de marca natural, oscila aproximadamente 33%.
Silla de montar: La silla de montar es una mancha más clara situada en el lado dorsal, justo después de la aleta dorsal. Su forma y coloración permanece estables en el tiempo y es única para cada individuo, permitiendo su diferenciación. Se trata de una marca lo suficientemente complicada para que no se den duplicaciones dentro de la misma población; se hereda genéticamente y es diferente en los dos sexos. No es visible en los individuos más jóvenes. Si combinamos esta característica con lo explicado anteriormente, el porcentaje de individuos identificados en la población se duplicará, de 33 a 67% (Auger-Méthé and Whitehead, 2007).
Heridas blancas: Se trata de heridas irregulares asociadas frecuentemente con la presencia de muescas y su formación estaría relacionada con éstos. Se ha visto que son estables en el tiempo y por lo tanto, podría ser utilizado en estudios de foto-identificación, aunque su presencia en la población es baja.
El calderón de aleta larga es una especie distribuida principalmente en aguas templadas y subpolares del Atlántico Norte y todos los océanos del hemisferio sur. La población mundial se estima en aproximadamente 1 millón de individuos, pero estos datos son bastante antiguos y se desconoce exactamente cuáles son las tendencias de abundancia de la población. A pesar de estos hechos, la Unión Internacional para la conservación de la naturaleza (UICN) ha incluido esta especie bajo la condición de deficiente de datos. En el Mediterráneo, la falta de conocimiento acerca de las ejemplares que viven allí y su abundancia, también ha llevado a estos organismos para clasificar las especies bajo la condición de deficiente de datos. Las principales amenazas a las que afectan a la especie son las siguientes:
El calderón de aleta larga está protegido por varios acuerdos internacionales como el Apéndice II de la Convención sobre comercio internacional de especies amenazadas de Flora Silvestre y Fauna (CITES) o el acuerdo sobre la conservación de los cetáceos del mar negro, mar Mediterráneo y zona Atlántica adyacente (ACCOBAMS). Algunas poblaciones están incluidas en el Apéndice II de la Convención de especies migratorias (CMS). Además, en el Mediterráneo, existe una área muy importante para los cetáceos, situada en el mar de Liguria, donde estos animales gozan de una protección especial. De hecho es que única área marina protegida, creada con la intención de proteger a los cetáceos y promover su conservación.
A pesar del hecho que se ha solicitado el establecimiento de áreas de especial interés en la parte norte del mar de Alborán y golf de Vera (Cañadas et al., 2005), no ha sido hasta finales del 2013, que el gobierno español ha designado nuevos lugares de marinos de interés comunitario, en el marco del proyecto Indemares y formando parte de la red Natura 2000. Entre las nuevas áreas designadas incluyen la extensión de la zona que rodea la isla de Alborán y la parte norte del mismo mar, zonas muy importantes en la distribución de las especies.
AGUILAR, A. 2000. Population biology, conservation threats and status of Mediterranean striped dolphins (Stenella coeruleoalba). Journal of Cetacean Research and Management 2(1):17-26
AMOS, B., BARRET, J., & DOVER, G. A. 1991. Breeding behaviour of pilot whales revealed by DNA fingerprinting. Heredity. 67:49-55
AUGER-MÉTHÉ, M. & WHITEHEAD, H. 2007. The use of natural markings in studies of long-finned pilot whales (Globicephala melas). Marine Mammal Science. 23(1):77-93
BAIRD, R. W., BORSANI, J. F., HANSON, M. B. & TYACK, P. L. 2002. <em. Marine Ecology Progress Series. 237:301-305</em
BLOCH, D., LOCKYER, C. & ZACHARIASSEN, M. 1993. Age and growth parameters of the long-finned pilot whale off the Faroe Islands. Report of the International Whaling Commission. Special Issue 14:163-207
BORRELL, A. & AGUILAR, A. 2006. Organochlorine concentrations declined during 1978 – 2002 in the western Mediterranean bottlenose dolphins, a coastal top predator. Cemosphere. 66:347-352
CAÑADAS A. & SAGARMINAGA, R. 1994. Estudio de distribución y dinámica de las poblaciones de cetáceos en las aguas del sudeste español. Proyecto Alnitak
CAÑADAS, A. & SAGARMINAGA, R. 2000. The northeastern Alboran Sea, an important breeding and feeding ground for the long-finned pilot whale (Globicephala melas) in the Mediterranean Sea. Marine Mammal Science. 16(3):513-529
CAÑADAS, A., SAGARMINAGA, R., DE STEPHANIS, R., URQUIOLA, E. & HAMMONS, P. S. 2005. Habitat preference modelling as aconservation tool: proposal for marine protected areas for cetaceans in southern Spanish waters. Aquatic Conservation: Marine and Freshwater Ecosystems. 15:495-521
CARWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
CAURANT, F., AMIARD-TRIQUET, C. & AMIARD J-C. 1993. Factors influencing the accumulation of metals in pilot whales (Globicephala melas) off the Faroe Islands. Reports of the International Whaling Commision. Special Issue 14:369-390.
DE STEPHANIS, R. 2008. Estrategias de alimentación, en función del tiempo, de los diferentes grupos de calderón común (Globicephala melas) en el Estrecho de Gibraltar en primavera-verano. Tesis doctoral. Universidad de Cádiz, España
DE STEPHANIS, R., VERBORGH, P., PÉREZ, S., ESTEBAN, R., MINVIELLE-SEBASTIA, L. & GUINET, C. 2008a. Long-term social structure of long-finned pilot whales (Globicephala melas) in the Strait of Gibraltar. Acta Ethologica. 11:81-94
DE STEPHANIS, R., CORNULIER, T., VERBORGH, P., SALAZAR SIERRA, J., PÉREZ GIMENO, N. & GUINET, C. 2008b Summer spatial distribution of cetacens in the Strait of Gibraltar in relation to the oceanographic context. Marine Ecology Progress Series. 353:275-288
DE STEPHANIS, R., GARCÍA-TISCAR, S., VERBORGH, P., ESTEBAN-PAVO, R., PÉREZ, S., MINVIELLE-SEBASTIA, L. GUINET, C. 2008c. Diet of social groups of long-finned pilot whales (Globicephala melas) in the Strait of Gibraltar. Marine Biology. 154:603-612
DESPORTES, G. & MOURITSEN, R. 1993. Preliminary results on the diet of long-finned pilot whales off the Faroe Islands. Report of the International Whaling Commission. Special Issue 14:305-324
FERNÁNDEZ, A., ESPERÓN, F., HERRAÉZ, P., ESPINOSA DE LOS MONTEROS, A., CLAVEL, C., BERNABÉ, A., SÁNCHEZ-VIZCAINO, J. M., VERBORGH, P., DE STEPHANIS, R., TOLEDANO, F. & BAYÓN A. 2008. Morbillivirus and pilot whale deaths, Mediterranean Sea. Emerging Infectious Diseases. 14:792-794
GANNIER, A. 2005. Summer distribution and relative abundance of delphinids in the Mediterranean sea. Revue d’Ecologie (La Terre et la Vie) 60:223-238
GANNON, D. P., READ, A. J., CRADDOK, J. E., FRISTRUP, K. M. & NICOLAS, J. R. 1997. Feeding ecology of long-finned pilot whales Globicephala melas in the western North Atlantic. Marine Ecology Progress Series. 148:1-10
GERACI, J. R. & LOUNSBURY, V. J. 2005. Marine mammals ashore: A field guide for strandings. 2nd edition. National Aquarium in Baltimore.
IUCN 2012. Marine Mammals and Sea Turtles of the Mediterranean and Black Seas. Gland, Switzerland and Malaga, Spain: IUCN. 32 pages.
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
MANGION, P. & GANNIER, A. 2002. Improving the comparative distribution picture for Risso’s dolphin and long- finned pilot whale in the Mediterranean Sea. 16th Conference of the European Cetacean Society (Liège, 7-12 April): Abstracts.
MUSSI, B., MIRAGLIULO, A. & DÍAZ LÓPEZ, B. 2000. Social structure and male paternal care in a long-finned pilot whale (Globicephala melas) pod off Ventotene Island (Southern Tyrrenian Sea, Italy). European Research on Cetaceans. 14:141-145
NOTARBARTOLO DI SCIARA, G., VENTURINO, M. C., ZANARDELLI, M., BEARZI, G., BORSANI, F. J. & CAVALLONI, B. 1993. Cetaceans in the central Mediterranean sea: Distribution and sighting frequencies. Bolletino di Zoologia. 60:131-138
NOTARBARTOLO DI SCIARA, G. 2002. Cetacean species occurring in the Mediterranean and Black Seas. In: G. NOTARBARTOLO DI SCIARA (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 3, 17 p.
NOTARBARTOLO DI SCIARA, G. & BIRKUN A JR. 2010. Conserving whales and dolphins in the Mediterranean and Black seas. An ACCOBAMS status report. ACCOBAMS, Monaco. 212 p
OTTENSMEYER, C. A. & WHITEHEAD, H. 2003. Behavioural evidence for social units in long-finned pilot whales. Canadian Journal of Zoology. 81:1327-1338
PERRIN, W. F. & REILLY, S. 1984. Reproductive parameters of dolphins and small whales of the family Delphinidae. Report of the International Whaling Comission. (Special Issue 6):97-133
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
REEVES, R. R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 64 pp.
REIJNDERS, P. J. H. 1998. Reproductive and Developmental Effects of Endocrine-Disrupting Chemicals on Marine Mammals. in In: T.J. O’Shea, R.R. Reeves & A. Kirk Long (eds.) 1998. Marine mammals and persistent ocean contaminants: proceedings of the Marine Mammal Commission workshop, Keystone, Colorado. Marine Mammmal Commission, 1999, pp.93-100
SANTOS, M. B., MONTEIRO, S. S., VINGADA, J. V., FERREIRA, M., LÓPEZ, A., MARTÍNEZ CEDEIRA, J. A., REID, R. J., BROWNLOW, A. & PIERCE, G. J. 2014. Patterns and trends in the diet of long-finned pilot whales (Globicephala melas) in the northeastern Atlantic. Marine Mammal Science. 30(1):1-19
SHIRIHAI, H & JARRET, B. 2006. Whales dolphins and seals: A field guide to the marine mammals of the world. A & C Black, London
TYACK, P. 1986. Population biology, social behaviour and communication in whales and dolphins. Trends in Ecology & Evolution. 1(6):144-150
VERBORGH, P. 2005. Population estimation and survival rate of long finned pilot whales (Globicephala melas) in the Strait of Gibraltar. MsC Thesis. University of Bangor, UK.
VERBORGH, P., DE STEPHANIS, R., PÉREZ, S., JAGET, Y., BARBRAUD, C. & GUINET, C. 2009. Survival rate, abundance, and residency of long-finned pilot whales in the Strait of Gibraltar. Marine Mammal Science. 25(3):523-536
http://www.iucnredlist.org/details/16376479/0
http://www.iucnredlist.org/details/9250/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/
CC: Iris Anfruns | Imágenes cedidas para Associació Cetàcea